 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Дебая температура
ДЕБАЯ ТЕМПЕРАТУРА - характеристич. темп-ра 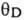 твёрдого тела, вводимая соотношением:
твёрдого тела, вводимая соотношением:

где  - макс. частота колебаний кристаллич. решётки, определяемая из условий равенства числа колебаний, приходящихся на частотный интервал от 0 до
- макс. частота колебаний кристаллич. решётки, определяемая из условий равенства числа колебаний, приходящихся на частотный интервал от 0 до 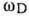 , полному числу колебат. степеней свободы решётки (см. Дебая теория).
, полному числу колебат. степеней свободы решётки (см. Дебая теория).
При низких темп-pax  в кристалле возбуждаются только низкочастотные колебания, частота к-рых
в кристалле возбуждаются только низкочастотные колебания, частота к-рых 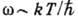 . Эти колебания характеризуются линейной зависимостью частоты
. Эти колебания характеризуются линейной зависимостью частоты 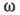 от волнового вектора
от волнового вектора 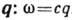 , где с- скорость звука (см. Колебания кристаллической решётки). Исходным пунктом теории Дебая является распространение акустич. закона дисперсии на все частоты вплоть до предельной
, где с- скорость звука (см. Колебания кристаллической решётки). Исходным пунктом теории Дебая является распространение акустич. закона дисперсии на все частоты вплоть до предельной 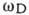 . Поскольку длина звуковой волны должна быть велика по сравнению с постоянной решётки а, то предельная частота
. Поскольку длина звуковой волны должна быть велика по сравнению с постоянной решётки а, то предельная частота 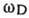 по порядку величины равна:
по порядку величины равна: 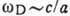 . Следовательно, для Д. т. справедлива порядковая оценка:
. Следовательно, для Д. т. справедлива порядковая оценка:

Более строгая ф-ла для Д. т. имеет вид:

где N - число элементарных ячеек, V - объём тела, 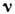 - число частиц в элементарной ячейке. Д. т. характеризует мн. свойства твёрдых тел:теплоёмкость,тепло- и электропроводность, упругие свойства, уширение линии рентг. спектров и т. п. Д. т. является характерным масштабом, разделяющим область высоких темп-р
- число частиц в элементарной ячейке. Д. т. характеризует мн. свойства твёрдых тел:теплоёмкость,тепло- и электропроводность, упругие свойства, уширение линии рентг. спектров и т. п. Д. т. является характерным масштабом, разделяющим область высоких темп-р 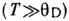 , в к-рой колебания кристаллич. решётки можно описывать классич. теорией и где, в частности, справедлив Дюлонга и Пти закон,и область низких темп-р
, в к-рой колебания кристаллич. решётки можно описывать классич. теорией и где, в частности, справедлив Дюлонга и Пти закон,и область низких темп-р 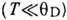 , где становятся существенными квантовомеханич. эффекты.
, где становятся существенными квантовомеханич. эффекты.
Д. т. обычно находят путём подгонки наблюдаемых значений уд. теплоёмкости к ф-ле, даваемой теорией Дебая, в точке, где величина теплоёмкости составляет половину от значения, соответствующего закону Дюлонга и Пти.
Для сложных кристаллич. решёток вводят т. н. ха-рактеристич. Д. т., к-рая подбирается так, чтобы соответствующие ф-лы правильно описывали наблюдаемые температурные зависимости, напр. теплоёмкости. При этом характеристич. Д. т. сама является ф-цией темп-ры. Эксперим. или теоретич. данные по теплоёмкости представляются в виде графика 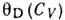 от T. Значение характеристич. Д. т. при T=0 можно вычислить теоретически, зная упругие постоянные решётки. Сравнение Д. т., полученных по измерению
от T. Значение характеристич. Д. т. при T=0 можно вычислить теоретически, зная упругие постоянные решётки. Сравнение Д. т., полученных по измерению 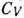 и вычисленных из упругих постоянных (табл. 2), позволяет получить информацию об особенностях межатомных связей и динамич. свойствах решётки кристалла.
и вычисленных из упругих постоянных (табл. 2), позволяет получить информацию об особенностях межатомных связей и динамич. свойствах решётки кристалла.
Табл. 2. -Значения характеристической температуры Дебая при T=0 К
| Вещество | 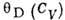 ,
К ,
К
| 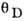 (упр.), К (упр.), К
| Вещество | 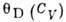 ,
К ,
К
| 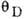 (упр.), К (упр.), К
| ||
| Cu | 345,2 | 344,4 | Mg | 404,6 | 385,8 | ||
| Ag | 226,0 | 226,4 | Zn | 305,5 | |||
| Au | 164,7 | 161,1 | Ge | 374,0 | - | ||
| LiF | 740,0 | 734,1 | Si | 674,8 | - |
Закон Дюлонга — Пти (Закон постоянства теплоёмкости) — эмпирический закон, согласно которому молярная теплоёмкость твёрдых тел при комнатной температуре близка к 3R[1]:
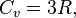
где R — универсальная газовая постоянная.
Закон выводится в предположении, что кристаллическая решетка тела состоит из атомов, каждый из которых совершает гармонические колебания в трех направлениях, определяемыми структурой решетки, причем колебания по различным направлениям абсолютно независимы друг от друга. При этом получается, что каждый атом представляет три осциллятора с энергией E, определяемой следующей формулой:
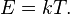
| Элемент |  , кал/(К·моль) , кал/(К·моль)
| Элемент | 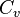 , кал/(К·моль) , кал/(К·моль)
|
| C | 1,44 | Pt | 6,11 |
| B | 2,44 | Au | 5,99 |
| Al | 5,51 | Pb | 5,94 |
| Ca | 5,60 | U | 6,47 |
| Ag | 6,11 | - | - |
Формула вытекает из теоремы о равнораспределении энергии по степеням свободы. Так как каждый осциллятор имеет одну степень свободы, то его средняя кинетическая энергия равна 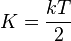 , а так как колебания происходят гармонически, то средняя потенциальная энергия равна средней кинетической, а полная энергия — соответственно их сумме. Число осцилляторов в одном моле вещества составляет
, а так как колебания происходят гармонически, то средняя потенциальная энергия равна средней кинетической, а полная энергия — соответственно их сумме. Число осцилляторов в одном моле вещества составляет 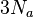 , их суммарная энергия численно равна теплоемкости тела — отсюда и вытекает закон Дюлонга-Пти.
, их суммарная энергия численно равна теплоемкости тела — отсюда и вытекает закон Дюлонга-Пти.
Приведем таблицу экспериментальных значений теплоемкости ряда химических элементов для нормальных температур:
Зависимость теплоёмкости от температуры при низких температурах объясняется в моделях Эйнштейна и Дебая.
№48
Поиск по сайту: