 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Температура замерзания и кипения разбавленных растворов
(следствия из закона Рауля).
Растворы замерзают при более низкой, а закипают при более высокой температуре, чем чистый растворитель. Эти закономерности относятся только к растворам нелетучих веществ в разбавленных растворах, для которых мольная доля растворенного вещества (N) близка к нулю.
Действительно, если давление пара над раствором понижено (Р < P0), то последний нужно нагреть до более высокой температуры, чтобы достигнуть равенства давления пара над раствором и внешнего давления, обеспечивающего кипение (рис. 7.1). Из рис. 7.1 следует, что внешнее давление (РВН) достигается растворителем при температуре ТЕ, а раствором - при Т > TE, так как Р < P0.
Метод исследования, основанный на измерении повышения температуры кипения растворов, называется эбулиоскопическим [ebulliare (лат.) - выкипать], а сам эффект - эбулиоскопическим эффектом.
Условие кипения раствора:
Р = Р0 N0 = РВН, (7.4)
где РВН = 1 (условная единица).
После логарифмирования (7.4) с учетом РВН = 1:
lnР0 + lnN0 = 0,

|
а после дифференцирования:
 .
.
Из уравнения Клазиуса - Клапейрона следует:
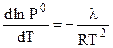 ,
,
поэтому
 , (7.5)
, (7.5)
где  - молярная теплота испарения растворителя.
- молярная теплота испарения растворителя.
После разделения переменных и интегрирования (7.5):
| Рис. 7.1. Повышение температуры кипения раствора: ТЕ, Т - температура кипения чистого растворителя и раствора соответственно; РВН - внешнее давление. |

или
 ,
,
где  .
.
Для разбавленных растворов  , а N << N0.
, а N << N0.
Тогда:  , причем точность расчета при этом не хуже 1%, если N < 0,02.
, причем точность расчета при этом не хуже 1%, если N < 0,02.
Таким образом:
 . (7.6)
. (7.6)
Из (7.6) очевидно, что повышение температуры кипения раствора не зависит от природы растворенного вещества, а определяется лишь его молярной долей в растворе.
Выражению (7.6) можно придать иную форму записи, если концентрацию раствора выразить в единицах его моляльности (m):
 , (7.7)
, (7.7)
где 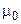 - молярная масса растворителя.
- молярная масса растворителя.
В разбавленном растворе  , поэтому N = m
, поэтому N = m 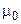 и соотношение (7.6) запишется в виде:
и соотношение (7.6) запишется в виде:
 , (7.8)
, (7.8)
где  = kЭ - эбулиоскопическая постоянная растворителя.
= kЭ - эбулиоскопическая постоянная растворителя.
Тогда:
 . (7.9)
. (7.9)
Эбулиоскопическая постоянная, называемая также молярным повышением температуры кипения, представляет собой величину повышения температуры кипения раствора, содержащего 1 моль растворенного вещества в 1 кг растворителя, по сравнению с температурой кипения чистого растворителя. Каждый растворитель имеет свою эбулиоскопическую постоянную, не зависящую от природы растворенного вещества: kЭ для воды составляет 0,52 К/моль, для бензола 2,57 К/моль.
Эбулиоскопическим методом определяют молярные массы растворенных веществ, однако его используют лишь в тех случаях, когда растворенное вещество нелетучее и растворитель не диссоциирует при температуре кипения раствора.

|
Другим следствием понижения давления насыщенного пара растворителя над раствором нелетучего растворенного вещества является то, что температура замерзания (кристаллизации) раствора ниже, чем чистого растворителя (рис. 7.2).
Совершенно очевидно, что если при замерзании раствора вымораживается чистый растворитель, то условие замерзания раствора имеет вид:
 , (7.10)
, (7.10)
где Р - давление пара растворителя над раство-
ром;
 - давление пара растворителя над чис-
- давление пара растворителя над чис-
тым твердым растворителем.
Условие замерзания чистого растворителя:
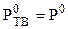 . (7.11)
. (7.11)
Согласно уравнению Клаузиуса - Клапейрона (4.80):
| Рис. 7.2. Понижение температуры замерзания раствора: Тf, T - температуры замерзания растворителя и раствора соответственно. |
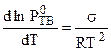 и
и 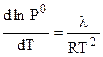
Совместное решение этих уравнений дает:
 , (7.12)
, (7.12)
где  - молярная теплота плавления.
- молярная теплота плавления.
При температуре замерзания раствора  , поэтому
, поэтому  , где
, где  .
.
Тогда окончательно:
 . (7.13)
. (7.13)
Уравнение (7.13) называется уравнением Шредера. Его решение позволяет рассчитать понижение температуры замерзания раствора:
 или
или  , (7.14)
, (7.14)
где  - криоскопическая постоянная растворителя, зависящая как и kЭ только от свойств рас-
- криоскопическая постоянная растворителя, зависящая как и kЭ только от свойств рас-
творителя.
Из (7.14) следует, что понижение температуры замерзания разбавленных растворов определяется только концентрацией растворенного вещества.
 Криоскопический метод используется как и эбулиоскопический для определения молярных масс растворенных веществ, однако им пользоваться удобнее, так как для водных растворов
Криоскопический метод используется как и эбулиоскопический для определения молярных масс растворенных веществ, однако им пользоваться удобнее, так как для водных растворов  в несколько раз больше kЭ, поэтому точность оценок повышается. Так
в несколько раз больше kЭ, поэтому точность оценок повышается. Так  для воды составляет 1,86 К/моль, для бензола - 5,2 К/моль. Как в том, так и в другом методе точность опыта зависит от точности определения
для воды составляет 1,86 К/моль, для бензола - 5,2 К/моль. Как в том, так и в другом методе точность опыта зависит от точности определения  . Для повышения точности определения в случае водных растворов пользуются термометром Бекмана, особенностью которого является большая длина шкалы (0,05 м на 1 К). В верхней части термометра имеется резервуар со ртутью, позволяющей изменять количество ртути в рабочей части термометра.
. Для повышения точности определения в случае водных растворов пользуются термометром Бекмана, особенностью которого является большая длина шкалы (0,05 м на 1 К). В верхней части термометра имеется резервуар со ртутью, позволяющей изменять количество ртути в рабочей части термометра.
Поиск по сайту: