 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
От температуры и давления
Полученные сведения о равновесии можно дополнить, установив зависимость константы равновесия от температуры и давления. Дифференцирование уравнения (4.93) по температуре дает:
 . (4.94)
. (4.94)
Полученное выражение и значение АР из уравнения (4.93) необходимо ввести в уравнение Гиббса - Гельмгольца:
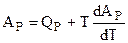
и получить
 ,
,
откуда после упрощений:
 . (4.95)
. (4.95)
По аналогии:
 . (4.96)
. (4.96)
Или, учитывая соотношения  и
и  :
:
 и
и 
Полученные уравнения вида (4.95) и (4.96) - это уравнения изобары и изохоры химической реакции, устанавливающие зависимость константы равновесия химической реакции от температуры.
Интегрирование уравнений (4.95) и (4.96) в обобщенной форме их записи позволяет получить точное решение в виде:
 . (4.97)
. (4.97)
Если предположить, что Q 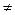 f (T), то решение уравнений (4.95) и (4.96) выглядит:
f (T), то решение уравнений (4.95) и (4.96) выглядит:
 . (4.98)
. (4.98)
Из (4.98) видно, что  , причем, если Q > 0 (экзотермическая реакция), то с ростом температуры значение k уменьшается, а если Q < 0 (эндотермическая реакция), то при увеличении температуры величина k, наоборот, увеличивается.
, причем, если Q > 0 (экзотермическая реакция), то с ростом температуры значение k уменьшается, а если Q < 0 (эндотермическая реакция), то при увеличении температуры величина k, наоборот, увеличивается.
Сделанные выводы представляют собой частный случай принципа Ле-Шателье (или принцип подвижного равновесия), который позволяет в простейших случаях предвидеть направление течения химической реакции. Согласно этому принципу, изменение внешних условий (Т и Р) термодинамической равновесной системы вызывает в ней процессы, противодействующие произвольному изменению.
Например для реакций вида:
N2 + O2  2NO - 180,0 кДж,
2NO - 180,0 кДж,
2NО + O2  2NO2 + 111,3 кДж
2NO2 + 111,3 кДж
повышение температуры сдвинет первое равновесие в сторону образования NO, а второе равновесие - в сторону диссоциации NО2.
Константа равновесия kP пропорциональна функции 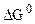 , но стандартная функция энергия Гиббса определяется при строго фиксированном давлении. Следовательно, некорректно обсуждать изменение kP при изменении давления для случая идеальных газов. Таким образом при постоянной температуре:
, но стандартная функция энергия Гиббса определяется при строго фиксированном давлении. Следовательно, некорректно обсуждать изменение kP при изменении давления для случая идеальных газов. Таким образом при постоянной температуре:
 . (4.99)
. (4.99)
Но это вовсе не означает, что при изменении давления количество веществ, находящихся в равновесии не изменяется. Поэтому изменение давления влияет на kN реакции. Из уравнения (4.90):
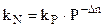
и затем:
 .
.
Отсюда после дифференцирования при постоянной температуре:
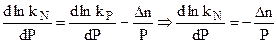 .
.
Используя уравнение состояния идеального газа PV = nRT и считая Р и Т постоянными: Р  V =
V =  nRT. Подставляя
nRT. Подставляя  в полученное уравнение kN = f (P), можно получить уравнение:
в полученное уравнение kN = f (P), можно получить уравнение:
 , (4.100)
, (4.100)
называемое уравнением Планка.
Если химическая реакция сопровождается уменьшением количества вещества ( n < 0), то
n < 0), то 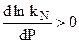 , и с увеличением давления в системе равновесие смещается в сторону конечных продуктов химической реакции, что обеспечивает большую полноту превращения исходных продуктов химической реакции в конечные.
, и с увеличением давления в системе равновесие смещается в сторону конечных продуктов химической реакции, что обеспечивает большую полноту превращения исходных продуктов химической реакции в конечные.
Поиск по сайту: