 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Различные формы констант равновесия и связь между ними
 - константа равновесия, выраженная через молярные концентрации веществ, участвующих в химической реакции.
- константа равновесия, выраженная через молярные концентрации веществ, участвующих в химической реакции.
Кроме того константу равновесия можно выразить через парциальные давления реагирующих веществ:
 .
.
Константу равновесия можно выразить через числа молей веществ - участников реакции:
 .
.
Константу равновесия можно выразить и через мольные доли участников реакции:
 .
.
В общем случае kC 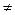 kP
kP 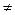 kn
kn 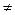 kN, но между ними существует связь. Для ее установления целесообразно обратиться к химической реакции, записанной в общем виде:
kN, но между ними существует связь. Для ее установления целесообразно обратиться к химической реакции, записанной в общем виде:
 . (4.87)
. (4.87)
 .
.
Откуда
 , (4.88)
, (4.88)
где  - изменение количества вещества в результате химической реакции.
- изменение количества вещества в результате химической реакции.
Для идеальных газов их парциальные давления связаны с общим давлением соотношением:
 ,
,
поэтому:
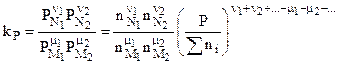
или
 . (4.89)
. (4.89)
Далее:
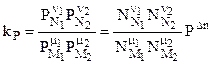
или окончательно:
 . (4.90)
. (4.90)
Поиск по сайту: