 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Уравнение Клаузиуса - Клапейрона
Процессы, заключающиеся в превращении одной фазы данного вещества в другую фазу того же вещества, т. е. протекающие без химических реакций называются фазовыми.
Примеры фазовых превращений (фазовых переходов) предложены в форме нижеследующих уравнений:
- испарение:
 , (4.73)
, (4.73)
где  - теплота испарения.
- теплота испарения.
- сублимация (возгонка):
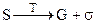 , (4.74)
, (4.74)
где 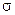 - теплота сублимации.
- теплота сублимации.
- плавление:
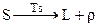 , (4.75)
, (4.75)
где 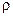 - теплота плавления.
- теплота плавления.
- полиморфное превращение:
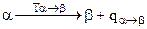 , (4.76)
, (4.76)
где 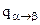 - теплота полиморфного превращения. Например при Т = 910 0С осуществляется полиморфное превращение, связанное с изменением типа кристаллической решетки железа: решетка
- теплота полиморфного превращения. Например при Т = 910 0С осуществляется полиморфное превращение, связанное с изменением типа кристаллической решетки железа: решетка  типа О. Ц. К. перестраивается в решетку Г. Ц. К.
типа О. Ц. К. перестраивается в решетку Г. Ц. К.
Основная характеристика фазового превращения - его температура, при которой фазы находятся в равновесии. Эта температура зависит от давления, например температура плавления льда или температура кипения воды изменяются с изменением величины давления.
Таким образом, состояние термодинамического равновесия двух фаз определяется соотношением между равновесной температурой и равновесным давлением.
Для установления этой связи рассмотрим две фазы (I и II) вещества, находящиеся в состоянии равновесия при р, Т = const. В этой ситуации справедливо равенство их молярных энергий Гиббса:
GI = GII. (4.77)
Условием сохранения равновесия при малых изменениях р и Т служит соотношение:
dGI = dGII. (4.78)
Согласно уравнению: dG = Vdp - SdT, (4.78) запишется в виде:
VIdp - SIdT = VIIdp - SIIdT, (4.78)
где VI, VII - молярные или удельные объемы фаз;
SI, SII - молярные или удельные энтропии фаз.
Из (4.78) следует:
(SII - SI)dT = (VII - VI)dp или 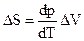 , (4.79)
, (4.79)
где 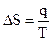 .
.
Тогда окончательно:
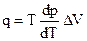 , (4.80)
, (4.80)
где q - энергетический эффект фазового перехода.
Полученное уравнение называется уравнением Клазиуса - Клапейрона и связывает термодинамические параметры (р и Т) между собой.
Для фазового перехода “испарение”, уравнение (4.80) приобретает форму:
 , (4.81)
, (4.81)
где VП, VЖ - молярные или удельные объемы пара и жидкости.
Так как  > 0 и VП >> VЖ, то
> 0 и VП >> VЖ, то 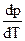 > 0, т. е. с увеличением температуры, давление насыщенного пара увеличивается.
> 0, т. е. с увеличением температуры, давление насыщенного пара увеличивается.
Так для воды  = 2,25 МДж/кг, VП = 1,65 м3/кг, VЖ = 10-3м3/кг, тогда
= 2,25 МДж/кг, VП = 1,65 м3/кг, VЖ = 10-3м3/кг, тогда 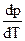 = 3,61 кПа/К.
= 3,61 кПа/К.
Для фазового перехода “сублимация”:
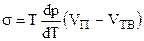 , (4.82)
, (4.82)
где VТВ - молярный или удельный объем твердой фазы.
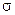 > 0, VП >> VТВ, поэтому
> 0, VП >> VТВ, поэтому 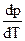 > 0.
> 0.
Для фазового перехода “плавление”:
 , (4.83)
, (4.83)
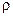 > 0, обычно VЖ > VТВ и
> 0, обычно VЖ > VТВ и 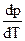 > 0, т. е. с ростом давления в системе, температура фазового перехода увеличивается. Но для воды, Bi, Ga, некоторых марок чугунов VЖ < VТВ и
> 0, т. е. с ростом давления в системе, температура фазового перехода увеличивается. Но для воды, Bi, Ga, некоторых марок чугунов VЖ < VТВ и 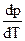 < 0.
< 0.
Так 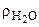 = 334 кДж/кг;
= 334 кДж/кг; 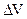 = -0,09
= -0,09 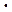 10-3 м3/кг и
10-3 м3/кг и 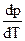 = - 0,0753 К/МПа.
= - 0,0753 К/МПа.
Для полиморфного превращения 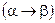 уравнение Клазиуса - Клайперона (4.80) запишется:
уравнение Клазиуса - Клайперона (4.80) запишется:
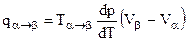 . (4.84)
. (4.84)
Если происходит превращение вида 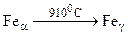 , то
, то 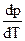 = - 0,0082 К/МПа.
= - 0,0082 К/МПа.
Рассматривая фазовый переход “испарение” можно получить частную форму записи уравнения (4.80).
Изменение объема в этом случае:
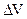 = VП - VЖ
= VП - VЖ  VП.
VП.
Если пар - идеальный газ, то:
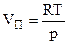 , (4.85)
, (4.85)
После замены:
 или
или 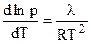 . (4.86)
. (4.86)
Уравнение (4.86) - уравнение кривой давления насыщенного пара.
Точным его решением служит интеграл:

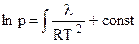 , (4.86)
, (4.86)
где 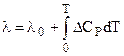 .
.
Тогда:
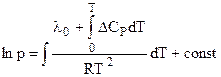 или
или 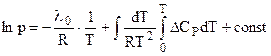
и окончательно:
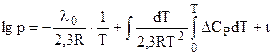 , (4.87)
, (4.87)
где 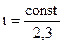 - истинная химическая постоянная.
- истинная химическая постоянная.
Таким образом, для нахождения величины давления насыщенного пара нужно знать  и
и  = f (Т).
= f (Т).
Существуют и приближенные способы решения уравнения (4.87).
1. Пусть  = const, т. е.
= const, т. е.  = 0, тогда:
= 0, тогда:
 . (4.88)
. (4.88)
Это приближение слишком грубо и годится лишь для очень приближенной оценки величины давления.
2. Лучшим приближением является допущение, что  = const, тогда
= const, тогда  .
.
В этом случае:
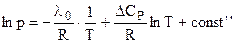 . (4.89)
. (4.89)
3. Следующее достаточно точное и часто применяемое приближение предложено Вальтером Нернстом:  , тогда:
, тогда:
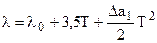 . (4.90)
. (4.90)
После решения уравнения (4.86) с учетом (4.90):
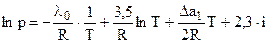 , (4.91)
, (4.91)
где i - условная химическая постоянная, причем 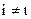 .
.
4. Более точный расчет может быть произведен с помощью таблиц термодинамических функций в стандартном состоянии, о чем будет сказано ниже.
Поиск по сайту: