 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Для расчета химического сродства
Использование первого и второго законов термодинамики для расчетов химического сродства связано с решением дифференциальных уравнений. Их интегрирование приводит к появлению констант интегрирования, значения которых не могут быть найдены.
Например, при расчете химического сродства по уравнению изотермы химической реакции (4.92) появляется необходимость интегрирования уравнений изобары или изохоры (4.95, 4.96). При этом появляется неопределенная const интегрирования:
 ,
,
где 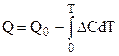 ,
,
поэтому окончательно:
 .
.
В полученное уравнение входят теплоемкости веществ, участвующих в реакции в зависимости от температуры вплоть до Т, а также тепловой эффект химической реакции при одной из температур в интервале, включающем Т.
Теплоемкости и тепловые эффекты являются термическими величинами. Их измерения производятся в калориметрах различных типов. Наиболее сложным является определение константы равновесия реакции, т. к. ее расчет невозможен в силу неопределенности const.
Расчет сродства возможен и по уравнению (4.56):
 G =
G =  H - T
H - T  S,
S,
где  S может быть определено из уравнения второго закона термодинамики (4.21):
S может быть определено из уравнения второго закона термодинамики (4.21):
 , (5.1)
, (5.1)
интегрирование которого приводит к следующему результату:
 , (5.2)
, (5.2)
где величина const не определена.
Таким образом, решение основной задачи химической термодинамики - расчета величины химического сродства наталкивается на недостаточность первого и второго законов термодинамики. Выход из этой неопределенности можно искать в двух направлениях. Во-первых, можно находить значение const эмпирическим путем, о чем уже говорилось выше. Но создание соответствующей целям измерения аппаратуры, особенно для изучения высокотемпературных металлургических реакций, связано с большими трудностями, а кроме того, достижение равновесия во многих случаях требует длительного времени.
Развитие химической промышленности и металлургии в начале века потребовало многочисленных данных для расчета химического сродства, причем только на основании сравнительно простых измерений термических величин.
Поэтому потребовалось отыскание общего, дополнительного к обоим законам термодинамики начального условия, позволяющего находить значения константы интегрирования, не прибегая к прямому эксперименту. Эту задачу впервые решил В. Нернст в 1906 г. Его работы, а также работы М. Планка привели к введению новых теорем и постулатов, составивших содержание третьего начала термодинамики.
Поиск по сайту: