 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Растворы электролитов
Многие химические соединения (соли, кислоты и т. д.) в растворенном или расплавленном состоянии способны проводить электрический ток. Такие вещества называются электролитами. Передача электричества в них осуществляется миграцией[3] ионов - положительно (катионы) и отрицательно (анионы) заряженных материальных частиц.
Электролиты - проводники второго рода, в отличие от металлов, относящихся к проводникам первого рода, у которых перенос электричества осуществляется миграцией электронов.
При наложении электрического поля в электролите происходит явления электролиза. Электролиз следует понимать как совокупность окислительно - восстановительных реакций на электродах электролитической ячейки (электролизера).
Электрод, на котором осуществляется окислительный процесс, связанный с потерей веществом электронов, называют анодом. А электрод, на котором происходит восстановительный процесс - катодом.
Количественно явление электролиза описывается законами Фарадея.
Первый закон Фарадея. Масса вещества (m), выделившегося при электролизе на катоде, прямо пропорциональна величине электрического заряда (q), прошедшего через электролит:
m = k 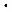 q, (8.1)
q, (8.1)
где k - электрохимический эквивалент вещества, кг/Кл.
Второй закон Фарадея. Электрохимические эквиваленты веществ (k) прямо пропорциональны их химическим эквивалентам 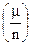 :
:
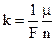 , (8.2)
, (8.2)
где F - число Фарадея, равное 96500 Кл/моль;
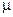 - мольная масса вещества;
- мольная масса вещества;
n - заряд иона.
Из объединенного закона электролиза Фарадея:
 , (8.3)
, (8.3)
следует, что число Фарадея численно равно электрическому заряду, который нужно пропустить через электролит для выделения на электроде массы любого вещества, равной в килограммах отношению  .
.
Поиск по сайту: