 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Глава 7. Растворы
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Наиболее важный вид растворов – жидкие растворы. Раствор состоит из растворенных веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов.
7.1. Способы выражения концентрации растворов. Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Различают массовую, молярную (мольно-объемную), моляльную, титр, мольную долю и другие величины, выражающие содержание растворенного вещества в растворе. Разберем их на конкретных примерах.
Пример 1. Вычислите: а) массовую (процентную) (с, %); б) молярную концентрацию (см); в) молярную концентрацию эквивалента (сн); г) моляльную (см) концентрацию раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр (T) этого раствора?
Решение: а) Массовая концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 + 282 = 300 г и, следовательно:
300 – 18
100 – с,%
100 ∙18
 с,% = = 6%
с,% = = 6%
б) молярная (мольно-объемная) концентрация показывает число молей растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора 1031 г (1000´1,031). Массу кислоты в литре раствора находим из соотношения
300 – 18
1031 – х
1031 ∙18
 х = = 61,86
х = = 61,86
Молярную концентрацию раствора получим делением числа граммов Н3РO4 в 1 л раствора на молярную массу Н3РО4 (97,99 г/моль):
см = 61,86 / 97,99 = 0,63 м
в) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса Н3РO4 = М/3 = 97,99/3 = 32,66 г/моль, то
сН = 61,86 / 32,66 = 1,89 н
г) моляльная концентрация (или моляльность) показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу Н3РО4 в 1000 г растворителя находим из соотношения
282 – 18
1000 – х
1000 ∙ 18
 х = = 68,83
х = = 68,83
Отсюда См = 63,83/97,99 = 0,65 м.
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то T= 61,86/1000 = 0,06186 г/см3.
Зная молярную концентрацию эквивалента (cн) и молярную массу эквивалента (mэ) растворенного вещества, титр легко найти по формуле:
Т = сн mЭ / 1000
Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н. раствора щелочи. Чему равна молярная концентрация эквивалентов кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной молярной концентрации эквивалентов реагируют в равных объемах. При разных молярных концентрациях эквивалентов объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
V1: V2 = cн2: cн1 или V1cн1 = V2 ∙ cн2
50cн1 = 25 ∙ 0,5 откуда cн1 = 25 ∙ 0,5 / 50 = 0,25н
Пример 3. К 1 л 10%-ного раствора КОН (пл. 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение. Масса одного литра 10%-ного раствора КОН равна 1092 г. В этом растворе содержится 1092 • 10/100 = 109,2 г КОН. Масса 0,5 л 5%-ного раствора 1045 • 0,5 = 522,5 г. В этом растворе содержится 522,5 • 5/100 = 26,125 г КОН.
В общем объеме полученного раствора (2 л) содержание КОН составляет 109,2 + 26,125 = 135,325 г. Отсюда молярная концентрация раствора cm = 135,325/(2 • 56,1) = 1,2 М, где 56,1 г/моль — молярная масса КОН.
Пример 4. Какой объем 96%-ной кислоты плотностью 1,84 г/см3 потребуется для приготовления 3 л 0,4 н. раствора?
Решение. Эквивалентная масса H2SO4 = М/2 = 98,08/2 = 49,04 г/моль. Для приготовления 3л 0,4н. раствора требуется 49,04 • 0,4 • 3= = 58,848 г H2SO4. Масса 1 см3 96%-ной кислоты 1,84 г. В этом растворе содержится 1,84 • 96/100 = 1,766 г H2SO4.
Следовательно, для приготовления 3 л 0,4 н. раствора надо взять 58,848: 1,766 = 33,32 см3 этой кислоты.
7.2. Коллигативные свойства растворов. К оллигативными являются свойства растворов, которые зависят от концентрации и практически не зависят от природы растворенных веществ. Они также называются общими (коллективными). Такие свойства могут проявляться в полной мере в идеальных растворах. Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы. Соответственно, образование этих растворов не сопровождается тепловым эффектом (∆Н=0) и каждый компонент ведет себя в растворе независимо от других компонентов. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы. К общим свойствам растворов относятся понижение давления насыщенного пара растворителя над раствором и температуры замерзания, повышение температуры кипения и осмотическое давление.
Молекулы нелетучего растворенного компонента раствора препятствуют улетучиванию из раствора молекул растворителя. Французский ученый Р. Рауль открыл закон, согласно которому понижение давления насыщенного пара растворителя А над раствором ∆рА пропорционально молярной доле растворенного нелетучего вещества хВ:
р0А –рА = ∆ рА = р0АхВ,
где р0А, рА - давления насыщенного пара растворителя соответственно над чистым растворителем и над раствором;
∆ рА – разность между давлениями насыщенного пара растворителя над раствором, рА и растворителем р0А
Из закона Рауля возникают два следствия. Согласно одному из них температура кипения раствора выше температуры кипения растворителя.
Повышение температуры кипения ∆ТКИП пропорционально моляльности раствора сm.
∆ТКИП = КЭ сm (1)
где КЭ — эбулиоскопическая постоянная растворителя.
Согласно второму следствию из закона Рауля температура замерзания (кристаллизации) раствора ниже температура замерзания (кристаллизации) чистого растворителя. Это обусловлено более низким давлением пара растворителя над раствором, чем над растворителем. Понижение температуры замерзания (кристаллизации) ДГзам пропорционально моляльности раствора, ∆ТЗАМ пропорцианально моляльности раствора
∆ТЗАМ = КК сm (2)
где КК — криоскопическая постоянная.
Значения КЭ и КК зависят от природы растворителя
Используя уравнения (1) и (2), можно определить молярную массу вещества. Для этого экспериментально определяют повышение температуры кипения или замерзания раствора. Если известна масел растворенного вещества и растворителя т А, то молярную массу растворенного вещества МВ определяют по уравнению
103К т В

 МВ = ∙
МВ = ∙
∆Т т А
где К ≡КЭ и К≡ КК
Осмотическое давление. Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба. Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности, и заставляющей молекулы растворителя проникать через полупроницаемую перегородку. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа
рV=nRT или р=(n/V)RT,
откуда
р= cRT,
где р - осмотическое давление;
с — молярная концентрация раствора.
Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры. Растворы с одинаковым осмотическим давлением называются изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже внутриклеточного - гипотоническим.
Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (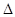 T) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением:
T) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением:
m1000
 ∆T = K
∆T = K
Mmi
где: К – криоскопическая или эбулиоскопическая константы. Для воды они соответственно равны 1,86 и 0,52;
т и М – соответственно масса растворенного вещества и его молярная масса;
тi – масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим по формуле (2): ∆Tзам = Кк ∙ Сm
2 ∙ 1000
 ∆T = 1,86 = 0,21˚
∆T = 1,86 = 0,21˚
180 ∙ 98
Вода кристаллизуется при 0°С, следовательно, температура кристаллизации раствора
0 - 0,21= -0,21 С.
По формуле (1) находим и повышение температуры кипения 2%-ного раствора:
2 ∙ 1000
 ∆T = 1,52 = 0,06˚
∆T = 1,52 = 0,06˚
180 ∙ 98
Вода кипит при 1000 С, следовательно, температура кипения этого раствора 100 + 0,06 = 100,06°C.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуглерода 46,3 0С. Вычислите эбулиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения 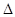 Т = 46,529-46,3 = 0,229°. Молярная масса бензойной кислоты 122 г/моль. По формуле (1) находим эбулиоскопическую константу:
Т = 46,529-46,3 = 0,229°. Молярная масса бензойной кислоты 122 г/моль. По формуле (1) находим эбулиоскопическую константу:
∆TMm1 0,299 · 122 · 100

 Kэ = = = 2,29˚
Kэ = = = 2,29˚
m1000 1,22 · 1000
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислите молярную массу глицерина.
Решение. Температура кристаллизации чистой воды 00С, следовательно, понижение температуры кристаллизации 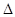 T = 0 - (-0,279) = 0,279°. Масса глицерина т (г), приходящаяся на 1000 г воды, равна:
T = 0 - (-0,279) = 0,279°. Масса глицерина т (г), приходящаяся на 1000 г воды, равна:
11,04 · 1000
 m = = 13,8
m = = 13,8
Подставляя в уравнение
m
 M = K
M = K
∆T
числовые значения, вычисляем молярную массу глицерина:
1,86 · 13,8
 М = = 92 г/моль
М = = 92 г/моль
0,279
Пример 4. Вычислите массовую долю (%) водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна 0,465°С.
Решение: Температура кристаллизации чистой воды 00С, следовательно, 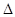 T = 0 - (-0,465) = + 0,465°. Молярная масса мочевины 60 г/моль. Находим массу т (г) растворенного вещества, приходящуюся на 1000 г воды, по формуле (2):
T = 0 - (-0,465) = + 0,465°. Молярная масса мочевины 60 г/моль. Находим массу т (г) растворенного вещества, приходящуюся на 1000 г воды, по формуле (2):
∆ТМ 0,46560

 т = = = 15
т = = = 15
К 1,86
Общая масса раствора, содержащего 15 г мочевины, составляет 1000 + 15 = 1015 г. Процентное содержание мочевины в данном растворе находим из соотношения
1015 г – 15 г
100 г – х
х = 1,48 %
7.3. Растворы электролитов. Примерами растворов электролитов могут служить растворы щелочей, солей и неорганических кислот в воде, растворы ряда солей и жидком аммиаке и некоторых органических растворителях, например ацетонитриле.
Растворы электролитов являются ионными проводниками (проводниками второго рода). В них наблюдаются отклонения от законом Рауля и Вант-Гоффа. Например, согласно закона Рауля, при введении 0,1 моль вещества на 1000 г воды температура замерзания должна снижаться на 0,186 К, а фактически снижается на 0,318 К у NaCl и 0,52 К-у MgCl2. Вант-Гофф ввел поправочный коэффициент i, называемый изотоническим коэффициентом и позволяющий использовать это уравнение для любых разбавленных растворов:
РОСМ = iс RT
Изотонический коэффициент характеризует отклонение от законов идеальных растворов вследствие электролитической диссоциации электролитов.
7.3.1. Степень диссоциации электролитов. В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита называется степенью диссоциации а. По степени диссоциации в растворах все электролиты делятся на две группы. К первой относят электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах принадлежит подавляющее большинство солей, щелочей, в также некоторые кислоты.
Электролиты, степень диссоциации которых в растворах меньше единицы и уменьшается с ростом концентрации, называют слабыми электролитами. К ним относят воду, ряд кислот, основания р-, d- и f -элементов. Между этими двумя группами нет четкой границы, одно и то же вещество в одном растворителе проявляет свойства сильного, а в другом — слабого электролита. Например, хлорид лития и иодид натрия, имеющие ионную кристаллическую решетку,
при растворении в воде ведут себя как типичные сильные электролиты,
при растворении же в ацетоне или уксусной кислоте эти вещества
являются слабыми электролитами со степенью диссоциации в раствоpax меньше единицы.
7.3.2. Слабые электролиты. Константа диссоциации. В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации кислоты
НА ↔ Н+ + А –
константа равновесия КС равна
[Н+] [А –]
 КС = КД =
КС = КД =
[НА]
Константа равновесия для процесса диссоциации называется константой диссоциацииКД. Например, константа диссоциации уксусной кислоты СН3СООН равна
[Н+] [СН3СОО –]
 КД =
КД =
[СН3СООН]
Для процесса диссоциации слабого основания
ROH ↔ R+ + OH
константа равновесия, называемая константой диссоциации основания, равна
[R +] [ОН –]
 КД =
КД =
[ROH]
Например, константа диссоциации гидроксида аммония
МН4ОН ↔ NH4+ + ОН –
равна
[NH4+ ] [ОН –]
 КД =
КД =
[NH4OH]
Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температурь и не зависит от концентрации раствора. С повышением температуры константа диссоциации обычно уменьшается, что в соответствии с принципом Ле Шателье свидетельствует об экзотермическим характере реакции.
Константа диссоциации указывает на прочность молекул в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы.
Степень диссоциации изменяется с концентрацией раствора. Рассмотрим зависимость степени диссоциации от концентрации слабого электролита на примере уксусной кислоты:
СН3СООН ↔ СН3СОО – + Н+
Принимая исходную концентрацию кислоты равной с, а степень диссоциации - а, получаем, что концентрация части кислоты, которая диссоциирована, будет равна ас. Так как при диссоциации одной молекулы кислоты образуется по одному иону Н+ и СН3СОО – , то их концентрации будут равны ас.
Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна с – ас2 = с ( 1 - а). Подставив значения равновесных концентраций ионов и кислоты в уравнение (1), получим:
[Н+] [СН3СОО –]
 КД =
КД =
[СН3СООН]
а2 с2 а2 с а2


 КД = = =
КД = = =
с (1 – а) 1 – а (1 – а)V (1)
где: V= 1/с
са 2
 или КД =
или КД =
1 – а
Уравнение (1) было получено Оствальдом и называется законом Оствальда. Если а «1, то уравнение упрощается:
КД ≈ а2с (2а)
и
a ≈  (26)
(26)
Уравнение (2а, 2б) называется законом разбавления Оствальда. Из него следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита. Аналогичное уравнение можно получить для слабого основания.
Многоосновные слабые кислоты и основания диссоциируют ступенчато, причем константа диссоциации по каждой последующей ступени всегда на несколько порядков ниже, чем по предыдущей.
7.3.3.Сильные электролиты. Многие свойства растворов, такие, как осмотическое давление, температура кипения и замерзания, давление насыщенного пара, зависят как от концентрации раствора, т. е. от числа растворенных в нем частиц, так и от взаимного влияния этих частиц друг на друга. Степень взаимодействия частиц в растворе тем выше, чем больше плотность их зарядов и чем меньше среднее расстояние между ними.
В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико вследствие их незначительной концентрации. Сильные электролиты в растворах диссоциированы практически полностью. Поэтому в уравнении диссоциации электролита стрелка указывает только на прямой процесс, например:
NaCl → Na+ + С1 –
А12 (SO4)3 → 2А13+ + 3 SO42 –
В растворах сильных электролитов из-за полной их диссоциации концентрация ионов велика. Поэтому свойства таких растворов существенно зависят от степени взаимодействия входящих в их состав ионов как друг с другом, так и с полярными молекулами растворителя. Взаимодействие ионов в растворах сильных электролитов приводит к тому, что катионы и анионы испытывают взаимное притяжение, а ионы одного знака заряда будут отталкиваться друг от друга. Поэтому в растворе каждый произвольно выбранный ион окружен в среднем во времени преимущественно противоположно заряженными ионами, как, например, в ионных кристаллах. Однако энергия теплового движения ионов в жидких растворах и значительно выше, чем в кристаллах. Поэтому ионы, взаимодействующие с выбранным центральным ионом, располагаются вокруг него не в виде кристаллической решетки, а в виде сферы, которая, согласно П. Дюбая и Э. Хюккеля, называется ионной атмосферой. В состав ионной атмосферы входят катионы и анионы. Однако преобладают ионы, противоположные по знаку заряда центральному иону. Суммарный заряд ионной атмосферы равен по величине заряду центрального иона и противоположен ему по знаку. Все ионы в растворе равноправны, поэтому каждый из них является центральным ионом и одновременно входит в состав ионной атмосферы другого иона. За счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т. е. ионная атмосфера имеет статистический характер.
Законы Рауля и Вант – Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активности. Активность а связана с концентрацией следующим соотношением:
а = γс
где γ – коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора.
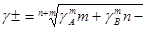
Поиск по сайту: