 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Электроотрицательность элементов по Полингу
| Н 2,1 | ||||||||||||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | ||||||||||
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | ||||||||||
| К 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Fe 1,8 | Co 1,9 | Ni 1,9 | Cu 1,9 | Zn 1,6 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
| Rb 0,8 | Sr 1,0 | Y 1,2 | Zr 1,4 | Nb 1,6 | Mo 1,8 | Tc 1,9 | Ru 2,2 | Rh 2,2 | Pd 2,2 | Ag 1,9 | Cd 1,7 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 |
| Cs 0,7 | Ba 0,9 | La-Lu 1,0-1,2 | Hf 1,3 | Ta 1,5 | W 1,7 | Re 1,9 | Os 2,2 | Ir 2,2 | Pt 2,2 | Au 2,4 | Hd 1,9 | Tl 1,8 | Pb 1,9 | Bi 1,9 | Po 2,0 | At 2,2 |
Таким образом наибольшие значения ОЭО имеют типичные неметаллы, наименьшие – активные металлы.
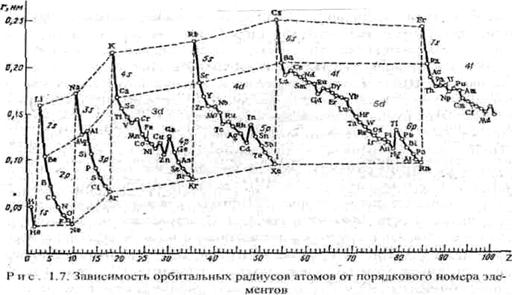
Атомные радиусы. Атомы не имеют строго определенных границ из-за корпускулярно-волнового характера электронов. Поэтому абсолютное значе ние радиуса атома определить невозможно. Можно условно принять за радиус атома теоретически рассчитанное значение расстояния от ядра до наиболее удаленного от него максимума электронной плотности - орбитальный радиус атома, или половину расстояния между центрами двух смежных атомов в кристаллах - эффективные радиусы атомов. Наблюдается периодичность изменения атомных радиусов (рис. 1.7), особенно у s- и p -элементов. У d- и f -элементов кривая изменения радиусов атомов по периоду имеет более плавный характер. В одной и той же группе с увеличением номера периода атомные радиусы, как правило, возрастают в связи с увеличением числа электронных оболочек. Однако увеличение заряда ядра при этом оказывает противоположный эффект, поэтому увеличение атомных радиусов с увеличением номера периода относительно невелико, а в некоторых случаях, например, у р -элементов III группы, значение орбитального радиуса у А1 больше, чем у Ga.
 Пример 1. Какую высшую и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Пример 1. Какую высшую и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение. Высшую степень окисления элемента определяет, как правило, номер группы периодической системы Д.И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2, пр6).
Данные элементы находятся соответственно в VA-, VIA-, VIIA-группах и имеют структуру внешнего энергетического уровня s2p3, s2p4 и s2p5. Ответ на вопрос см. в табл. 11.
Таблица 11.
Поиск по сайту: