 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Гибридизация орбиталей и пространственная конфигурация молекул
| Тип молекулы | Исходные орбитали атома А | Тип гибридизации | Число гибридных орбиталей атома А | Пространственная конфигурация молекулы |
| АВ2 АВ3 АВ4 | s+ р s + р+ р s+p+p+p | sp sp2 sp3 | Линейная Треугольная Тетраэдрическая |
Пример 9. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах F + 2 и О+2, чем, соответственно, в молекулах F2 и O2; наоборот, меньшую прочность связи в ионе N+2, чем в молекуле N2; существование молекулярного иона Не2+ и неустойчивость молекулы Не2 и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи — метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомной, соответствует более высокая энергия, чем атомной орбитали. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (cв) и разрыхляющими (разр). Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
σCB1s<σразр1s<σCB2s<σразр2s<σCB2px<πCB2py =
= πCB2pz<πразр2py=πразр2pz< σразр2x
На рис. 20 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрых  ляющих электронов зависит от их числа в атомах исходных элементов.
ляющих электронов зависит от их числа в атомах исходных элементов.
Следует отметить, что при образовании молекул N2 энергия связывающей  2рx-орбитали больше энергии связывающих
2рx-орбитали больше энергии связывающих  2ру- и
2ру- и  2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих
2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих  2ру- и
2ру- и  2рz-орбиталей больше энергии связывающей
2рz-орбиталей больше энергии связывающей  2рx-орбитали. Это нужно учитывать при изображении энергетических схем (см. рис. соответствующих молекул).
2рx-орбитали. Это нужно учитывать при изображении энергетических схем (см. рис. соответствующих молекул).
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.
Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляют формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-, f-орбиталями молекулярные орбитали обозначаются греческими буквами  . Так, электронная конфигурация молекулы O2 записывается следующим образом:
. Так, электронная конфигурация молекулы O2 записывается следующим образом:
O2 [КК (σsCB)2 (σsразр)2(σpxCB)2 (πpyCB)2 πpzразр πpyразр πpzразр]
Буквами КК показано, что четыре 1s-электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.
4.6. Металлическая связь. Само название говорит, что речь пойдет о внутренней структуре металлов. Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов. Так, по одному электрону содержат 16 элементов, по два — 56, по три — 4 элемента и ноль — только один Pd. В то же время на внешних уровнях атомов металлов много свободных орбиталей, что позволяет электронам близко подходить к положительным ядрам в любой части кристалла.
Из-за низкой энергии ионизации электроны в металле утрачивают связь с отдельными атомами, легко обобществляются, образуя электронный газ — совокупность свободных электронов. И самое главное состоит в том, что электроны в металле подвижны, легко перемещаются. Это подвижные, или нелокализованные, электроны.
Теперь можно представить металл как плотно упакованную структуру положительных ионов, связанных друг с другом электронным газом. При этом сравнительно небольшое число обобществленных электронов связывает большое число ионов.
Химическая связь, образующаяся в результате электрического притяжения между ионами металла и обобществленными электронами (электронным газом), называется металлической связью. Она характерна для металлов, сплавов и интерметаллических соединений. Природа связи — электрическая.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобщении валентных электронов. Однако при ковалентной связи обобщены валентные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны; в последнем случае возможно взаимное смещение ионов без нарушения связи. Это говорит о нелокализованности (отсутствии направленности) металлической связи. Для повышения твердости металлов в них вводят такие элементы, которые благоприятствуют образованию направленных - ковалентных - связей.
Таким образом, металлическая связь—это сильно нелокализованная химическая связь, возникающая в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, а валентные электроны из-за малой энергии ионизации слабо удерживаются ядром. Ею объясняются физические свойства металлов.
4.7. Водородная связь. Водородная связь — это своеобразная химическая связь. Она возникает между молекулами, в состав которых входит водород и сильно электроотрицательный элемент. Такими элементами являются фтор, кислород, азот, хлор и др.
Природу водородной связи объясняли по-разному. Наибольшее распространение получило электростатическое взаимодействие.
Механизм водородной связи рассмотрим на примере молекулы воды. При образовании полярной ковалентной связи между атомами водорода и атомом кислорода электроны, первоначально принадлежащие атому водорода, сильно смещаются в сторону кислорода. В результате атом кислорода приобретает значительный эффективный отрицательный заряд, а ядро атома водорода с внешней по отношению к атому кислорода стороны почти лишается электронного облака. Между протоном атома водорода и отрицательно заряженным атомом кислорода соседней молекулы воды возникает электростатическое притяжение, что и приводит к образованию водородной связи.
Процесс образования водородной связи на примере двух молекул воды может быть представлен следующей схемой (точками обозначается водородная связь, а знаками σ+, σ – - эффективные заряды атомов):
.. σ+ .. σ–
: О – Н ∙ ∙ ∙ О – Н
Н Н
Более правильным следует считать, что в образовании водородной связи принимает участие и донорно-акцепторное взаимодействие. Ведь для этой связи характерны направленность в пространстве и насыщаемость. На это впервые указал Н. Д. Соколов, разработавший квантово-механическую теорию водородной связи.
Согласно донорно-акцепторной теории, водородная связь начинается с электростатического взаимодействия, в результате которого электронная пара атомов водорода еще больше смещается в сторону кислорода, благодаря чему атом водорода как бы «оголяется», другими словами s-орбнталь атома водорода «высвобождается» и становится способной принять неподеленную электронную пару атома кислорода другой молекулы. Поле протона велико и притяжение им электронной пары атома кислорода весьма эффективно, в то время других своих электронов около протона нет, поэтому отталкивание другой молекулы воды в области атома водорода сильно понижается.
Этот механизм объясняет, почему только водород способен образовывать водородную связь. У всякого другого атома при освобождении орбитали ядро не «оголяется» и внутренние оболочки обеспечивают отталкивание от электронных оболочек второй молекулы.
Рассмотренный механизм образования водородной связи требует, чтобы атом элемента, соединяясь с водородом, обладал высокой относительной электроотрицательностью и имел в наличии неподеленную электронную пару. Только при этом условии электронное облако атома водорода достаточно сильно сместится в сторону атома партнера. Таким образом, химическая связь, образованная положительно поляризованным водородом молекулы А—Н (или полярной группы—А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью.
Образование водородной связи обусловлено тем, что в полярных молекулах А-Н или полярных группах -А-Н поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностьюи очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
Электростатическая модель образования водородных связей верна только в первом приближении, поскольку энергетически дополнительное связывание атома водорода должно иметь химическую природу. Метод валентных связей не может объяснить образование дополнительной связи атома Н, так как атом водорода одновалентен. Метод молекулярных орбиталей в его многоцентровом варианте дает следующее объяснение образования водородной связи. При сближении атома Н, ковалентно связанного с атомом электроотрицательного элемента Аδ- - Нδ+, с другим атомом также электроотрицательного элемента Вδ- возникает трехцентровая связывающая молекулярная орбиталь, пребывание в которой электронной пары атома В более выгодно, чем на атомной орбитали этого же атома.
Обычно водородную связь обозначают точками и этим указывают, что она слабее ковалентной связи (примерно в 15—20 раз). Тем не менее она ответственна за ассоциацию молекул. Например, образование димеров уксусной кислоты можно представить схемой агрегаций молекул за счет водородных связей:
1.Образование зигзагообразных цепей в жидком фтороводороде HF:

2. Образование гидрата аммиака NН3 ∙ Н2О при растворении аммиака в воде:
 Н σ– σ–
Н σ– σ–
 Н – N ∙ ∙ ∙ H – O
Н – N ∙ ∙ ∙ H – O
Н |
H
4.8. Взаимодействия между молекулами. При сближении молекул появляется притяжение, что обусловливает возникновение конденсированного состояния вещества. К основным видам взаимодействия молекул следует отнести вандерваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
4.8.1. Вандерваальсовы силы. В 1873 г. голландский ученый И. Ван-дер-Ваальс предположил, что существуют силы, обусловливающие притяжение между молекулами. Эти силы позднее получили название вандерваальсовых сил. Они включают в себя три составляющие: диполь-дипольное, индукционое и дисперсионное взаимодействия.
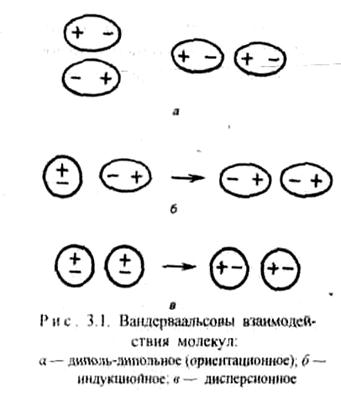 Диполь-дипольное взаимодействие. При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рис.3.1). Возникающее между диполями взаимодействие называется диполь-дипольным или ориентационным. Энергия диполь-дипольного взаимодействия пропорциональна электрическому моменту диполя в четвертой степени и обратно пропорциональна расстоянию между центрами диполей в шестой степени и абсолютной температуре в первой степени.
Диполь-дипольное взаимодействие. При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рис.3.1). Возникающее между диполями взаимодействие называется диполь-дипольным или ориентационным. Энергия диполь-дипольного взаимодействия пропорциональна электрическому моменту диполя в четвертой степени и обратно пропорциональна расстоянию между центрами диполей в шестой степени и абсолютной температуре в первой степени.
Индукционное взаимодействие. Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи (рис.3.1 ). Между постоянными и наведенными диполями возникает притяжение, энергия которого пропорциональна электрическому моменту диполя во второй степени и обратно пропорциональна расстоянию между центрами молекул в шестой степени. Энергия индукционного взаимодействия возрастает с увеличением поляризуемости молекул, т.е. способности молекулы к образованию диполя под воздействием электрического поля. Величину поляризуемости выражают в единицах объема. Поляризуемость в однотипных молекулах растет с увеличением размера молекул (табл. 14). Энергия индукционного взаимодействия значительно меньше энергии диполь-дипольного взаимодействия (табл. 14).
Дисперсионное притяжение. В любой молекуле или атоме благородного газа возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул (рис.3.1 ). Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц. Для неполярных молекул дисперсионное взаимодействие является единственной составляющей вандерваальсовых сил (табл. 14).
Таблица 14
Поиск по сайту: