 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Глава 4. Химическая связь и строение молекул
4.1. Определение химической связи. Свойства веществ зависят от их состава, строения, от типа химической связи между атомами в веществе. Химическая связь имеет электрическую природу. Под химической связью понимают вид взаимодействия между частицами в веществе (или характер распределения электронной плотности).
Современная теория химической связи была предложена в 1916 г. американским ученым Льюисом и одновременно с 'ним немецким ученым Косселем. В дальнейшем эти теории были дополнены, углублены, но являются основополагающими.
В образовании химических связей участвуют не все электроны атома, а только электроны внешнего уровня (у s- и p-элементов, т.е. у элементов главных подгрупп периодической системы) или электроны внешнего и недостроенного предвнешнего уровня (у d-элементов, т.е. у элементов побочных подгрупп). Электроны, способные к образованию химических связей, называются валентными. В зависимости от того, сколько электронов приняло участие в образовании химических связей, элемент может находиться в том или ином валентном состоянии (т.е. проявить определенную валентность).
Прежде валентностью элемента называли его способность присоединять или замещать определенное число атомов других элементов. В настоящее время понятие валентности связывают с определенным типом химической связи в веществе.
Соединение атомов в молекулы – энергетически выгодный процесс и всегда сопровождается выделением энергии, величина которой соответствует прочности (энергии) возникшей химической связи:
H+H=H2+103 ккал/моль
Cl+Cl=Cl2+58 ккал/моль
Теория строения атома объяснила причину объединения атомов в молекулы как стремление к устойчивой двух- или восьмиэлектронной внешней оболочке. Образование устойчивой электронной конфигурации может достигаться различными способами: отдачей, присоединением, обобществлением электронов. Таким образом, под химической связью понимаются различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ. К основным чертам химической связи можно отнести:
а) снижение общей энергии двух- или многоатомной системы по
сравнению с суммарной энергией изолированных частиц, из которых
эта система образована;
б) перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом.
Существует несколько типов химической связи, из которых важнейшими являются ионная, ковалентная, металлическая связь.
4.2. Ионная связь. При образовании любой молекулы, атомы этой молекулы «связываются» друг с другом. Причина образования молекул состоит в том, что между атомами в молекуле действуют электростатические силы. Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное.
Если на внешнем уровне содержится максимальное число электронов, которое атом может вместить, то такой уровень называется завершенным. Завершенные уровни характеризуются большой прочностью. Такие уровни имеют атомы инертных газов. Это и служит причиной того, что инертные газы при обычных условиях не вступают в химические реакции с другими элементами. Атомы других элементов имеют незавершенные энергетические уровни. В процессе химического взаимодействия они их завершают, т. е. приобретают структуру инертных газов.
Ионный тип связи возможен только у элементов, атомы которых резко отличаются по относительной электроотрицательности (см. раздел 3.3.), т.е. способности атомовсмещатьэлектронную плотность в молекуле к себе.
Рассмотрим электронное строение атомов некоторых металлов. неметаллов и инертного газа неона.
Электронная формула атома
натрия Is22s22p63s1 или [Ne] 3s1
кальция Is22s22p63s23p64s2 или [Ar] 4s2
хлора Is22s22p63s23p5 или [Ne] Зs23p5
кислорода Is22s2p4 или [He ]2s22p4
неона Is2s2p6
Как видно из электронного строения, атом неона имеет завершенный внешний энергетический уровень, состоящий из восьми электронов, а атомы металлов (натрия и кальция) и неметаллов (хлора и кислорода) — незавершенные энергетические уровни. В процессе химических реакций они стремятся завершить их, т. е. принять конфигурацию инертных газов.
Для завершения энергетических уровней атомам натрия и кальция легче отдать один и два электрона, а атомам хлора и кислорода легче принять один или два электрона. Это и происходит при образовании молекул.
Образование молекул хлорида натрия (NaCI) и оксида кальция (СаО) происходит по схеме:
 Na – ē → Na+[Ne]
Na – ē → Na+[Ne]
 Cl + ē →Cl–[Ar]
Cl + ē →Cl–[Ar]
Атом натрия теряет электрон и превращается в ион натрия, который приобретает конфигурацию инертного газа (Ne), а атом хлора присоединяет электрон, превращается в ион хлора, приобретая конфигурацию инертного газа аргона (Аг).
Аналогично происходит и образование молекулы оксида кальция
Ca – 2ē → Ca2+[Ar]
O + 2ē → O2– [Ne]
Ионы, вследствие сил электростатического притяжения, образуют молекулы. Соединения, которые образовались путем притяжения ионов, называются ионными.
Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной связью. Ионных соединений сравнительно немного. Современная теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда последняя переходит во владения одного из соединяющихся атомов, т. е. ионная связь — крайний случай ковалентной связи.
Таким образом, нет принципиального различия в механизме возникновения неполярной ковалентной, полярной ковалентной и ионной связей. Они различаются лишь степенью поляризации молекулярного электронного облака. Природа химической связи едина.
Для соединений с ионной связью характерны высокая температура кипения и плавления, электропроводностью обладают только в расплавленном состоянии, в воде легко диссоциируют на ионы.
Ионная связь характеризуется ненаправленностью и ненасыщаемостью.
Ненаправленность ионной связи. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределены во всех направлениях в пространстве. Поэтому каждый ион может притянуть к себе ионы противоположного знака в любом направлении (рис. 5).
Ненасыщаемость ионной связи. Взаимодействие двух ионов противоположного знака друг с другом не может привести к полной взаимной компенсации их силовых полей. В силу этого, у них сохраняется способность притягивать ноны противоположного знака и по другим направлениям (рис. 6).
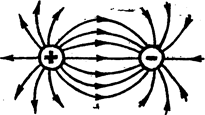

Рис.5 Ненаправленность ионной связи Рис.6 Ненасыщаемость ионной связи
4.3. Ковалентная связь. Химическая связь, осуществляемая за счет перекрывания электронных облаков взаимодействующих атомов, называется ковалентной связью.
4.3.1. Неполярная ковалентная связь. Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода.
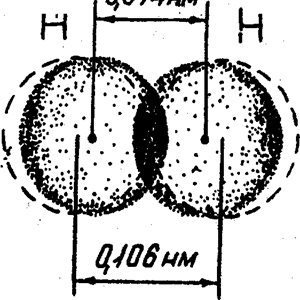
- Образование молекулы Н2. Ядро свободного атома водорода окружено сферически симметричным электронным облаком. При сближении атомов до определенного расстояния происходит перекрывание их электронных облаков с образованием молекулярного облака, обладающего максимальной электронной плотностью в пространстве между ядрами. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания (образования молекулы Н2) это расстояние сокращается до 0,074 нм (рис. 7). Увеличение плотности отрицательно заряженного электронного облака между положительно заряженными ядрами приводит к тому, что ядра как бы стягиваются этим облаком и возникает химическая связь.
Таким образом, ковалентная связь обеспечивается силами электростатического притяжения между сосредоточенной электронной плотностью в межъядерном пространстве, возникшей в результате перекрывания электронных облаков, и положительными зарядами ядер. Ковалентная связь тем прочнее, чем вше степень перекрывания электронных облаков. В результате возникновения связи между атомами водорода каждый атом достигает электронной
конфигурации инертного элемента гелия:
 < Н ∙ + ∙ Н → Н: Н или Н2
< Н ∙ + ∙ Н → Н: Н или Н2
- Образование молекулы хлора С12. В молекуле хлора ковалентная связь осуществляется с помощью двух общих электронов или электронной пары. Из семи валентных электронов каждый атом хлора имеет по одному неспаренному. Образование химической связи происходит за счет неспаренных электронов каждого атома. В результате образуется общая электронная пара, которая в равной мере принадлежит обоим атомам и, благодаря чему, каждый атом хлора завершает свой энергетический уровень, достигая конфигурации инертного элемента Рис. 7. Схема перекрывания электронных орбиталей аргона:
при образовании молекулы водорода.
∙ ∙ ∙ ∙ ∙ ∙ ∙ ∙
: С1 ∙ + ∙ С1 →: С1: С1: или С12
∙ ∙ ∙ ∙ ∙ ∙ ∙ ∙
Или, с точки зрения строения атома, это можно представить так:
электронная формула атома хлора Is22s22p63s23Sp5




↑↓ ↑↓ ↑↓ ↑
 3s Зр
3s Зр
При образовании молекулы происходит перекрывание р-орбиталей (рис. 8).
P P P - P
 | |||||||
 |  | ||||||
 | |||||||
+ -














Cl Cl Cl2
Рис. 8. Схема образования химической связи в молекуле хлора.
с точки зрения строения атома электронная формула атома азота выглядит так:



 ↑↓ ↑ ↑ ↑
↑↓ ↑ ↑ ↑
2s 2р
В молекуле азота связь осуществляется за счет перекрывания трех р-облаков, расположенных по оси х, у, z. Между атомами азота образуется одна сигма (σ) -связь и две пи – связи (π).
Связь, образованная при перекрывании электронных облаков вдоль линии, соединяющей центры взаимодействующих атомов, называется сигма (σ) - связью. Связь, образованная за счет перекрывания орбиталей по обе стороны от линии, соединяющей центры – атомов, называется пи – связью.
Наглядно это представлено на рисунке 9.
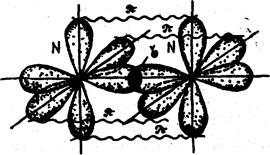
Рис. 9.Схема образования химической связи в молекуле азота.
Мы рассмотрели неполярную или гомеополярную ковалентную связь. При неполярной связи вероятность присутствия электронной плотности между ядрами одинакова. Центры тяжести положительных и отрицательных зарядов совпадают. Центром положительного заряда считают середину расстояния между ядрами. В молекулах простых газообразных веществ Н2, CI2, O2, N2 - в газообразной фазе наблюдается гомеополярная (неполярная) связь.
Вещества с неполярной ковалентной связью обладают низкими температурами кипения и плавления, в воде не диссоциируют, не проводят электрический ток.
4.3.2. Полярная ковалентная связь. Образование молекулы из атомов различных элементов происходит при помощи гетерополярной (полярной) ковалентной связи. Простейший случай гетерополярной связи — это образование молекулы хлорводорода. Образование молекулы НС1 можно представить схемой: ....
Н ∙ + ∙ С1: → Н: С1:
∙ ∙ ∙ ∙
Здесь происходит перекрывание s-облака атома водорода и р-облака атома хлора (рис. 10).

Рис. 10. Схема образования химической связи в молекуле хлороводорода.
Но в данном случае хлор обладает большей относительной электроотрицательностью. Поэтому происходит оттягивание электронной плотности к атому хлора. В молекуле возникает положительный и отрицательный полюсы. Химическая связь, в которой электронная плотность смещена к одному из партнеров, называется гетерополярной или полярной ковалентной связью. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше ЭО у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательности атомов характеризует полярность связи.
Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома и соответственно атом получает заряд, называемый эффективным зарядом атома δ -. У второго атома повышается плотность положительного заряда δ +. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) l д друг от друга. Мерой полярности связи служит электрический момент диполя равный произведению эффективного заряда на длину диполя l д
μСВ = δ l д
Электрический момент диполя имеет единицу измерения кулон на
метр (Кл∙м). В качестве единицы измерения используют также внесистемную единицу измерения дебай D, равную 3,3-10–30 Кл∙м
Полярную ковалентную связь с δ, приближающемуся к 1, можно считать ионной связью. Однако, даже у ионных соединений δ ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
Химическая связь в большинстве химических соединений сочетает свойства ковалентной и ионной связи. Поэтому ее можно считать ковалентной с определенной долей ионности. Степень ионности характеризуется эффективным зарядом атомов и возрастает с увеличением разности электроотрицательностей.
Рассмотренный выше механизм образования ковалентной связи (неполярной и полярной) называется обменным. Возможен и другой механизм образования ковалентной связи — донорно-акцепторной. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого. В качестве примера рассмотрим механизм образования иона аммония NH+:
NH3 + H+ → [NH4]+
В молекуле аммиакаазот имеет неподеленную пару электронов (двухэлектронное облако). Уиона водорода свободна ls-орбиталь. При сближении двухэлектронное облако азота становится общим как для атома азота, так и для атома водорода, т. е. оно превратилось в молекулярное электронное облако. А значит, возникла четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой:
H H
 .... +
.... +

 H: N: + H+ → H NH:
H: N: + H+ → H NH:
˙˙ ˙ ˙
H H
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т. е. предоставляющий свободную орбиталь), называется акцептором. Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным.
Таким образом, в катионе аммония четыре равноценные ковалентные связи: три образованные по обменному механизму и одна - по донорно-акцепторному.
Вещества с полярной ковалентной связью занимают по свойствам промежуточное положение между веществами с ионной связью и неполярной ковалентной связью. Ковалентному типу связи характерны атомные и молекулярные кристаллические решетки.
Провести границу между ионной и полярной ковалентными связями не всегда возможно. В соединениях, образованных тремя и более элементами, между атомами могут быть различные типы химической связи.
4.3.3. Свойства ковалентной связи. Ковалентная связь обычно характеризуется длиной связи, энергией связи, насыщаемостью и направленностью.
Длиной связи называется межъядерное расстояние между химически связанными атомами, когда силы притяжения уравновешены силами отталкивания и энергия системы минимальна. Химическая связь тем прочнее, чем меньше ее длина. Однако количественной мерой прочности связи являетсяее энергия.
Энергиясвязи равна тойэнергии, которая необходима для разрыва имеющихся в молекулесвязей.Обычно она измеряется в килоджоулях, отнесенных к 1 моль вещества, т. е. к 6,02 • 1023 связям. Так, согласно опытным данным, длины связи молекул водорода, хлора и азота соответственно составляют 0,074, 0,198 и 0,109нм(нанометра), а энергии связи соответственно равны 436, 242 и 946 кДж/моль. С увеличением кратности связи энергия связи увеличивается, а длина уменьшается.
Насыщаемость — это полное использование атомом валентных орбиталей. В результате он становится неспособным к установлению дополнительных связей. Например, нельзя присоединить еще атом водорода к молекулам Н2 или СН4. В этих молекулах связи насыщены. Благодаря насыщаемости связей молекулы имеют определенный состав: Н2, Н2О, НСl и т. д.
Направленность ковалентной связи обусловливает пространственную структуру молекул, т. е. их геометрию (форму). Ковалентная связь возникает в направлении максимального перекрывания электронных облаков (орбиталей) вдоль линии соединения атомов. При образовании молекулы НС1 происходит перекрывание s-орбитали атома водорода с р-орбиталью атома хлора. Молекула имеет линейную форму. Химические связи в молекуле воды направлены под углом 104,5°.
Ковалентные связи, образуемые многовалентными атомами, всегда имеют пространственную направленность. Углы между связями называются валентными.
4.4. Метод валентных связей (МВС, ВС). Для глубокого понимания сущности ковалентной связи, характера распределения электронной плотности в молекуле, принципов построения молекул простых и сложных веществ необходим метод валентных связей (ВС, МВС).
Метод валентных связей описывает механизм возникновения ковалентной связи и базируется на следующих основных принципах:
1. Химическая связь между двумя атомами осуществляется за счет одной или нескольких общих электронных пар.
Оба электрона общей электронной пары удерживаются одновременно двумя ядрами, что энергетически более выгодно, чем нахождение каждого электрона в поле «своего» ядра.
Такая химическая связь является двухцентровой.
2. При образовании общей электронной пары электронные облака перекрываются; область повышенной электронной плотности между ядрами способствует их притяжению. Чем сильнее перекрывание электронных облаков (соотношение R1 и R2), тем прочнее химическая связь (рис. 11).
3. При образовании общей электронной пары спины взаимодействующих электронов должны быть антипараллельны (т.к. электроны с параллельными спинами отталкиваются, и связь не образуется).
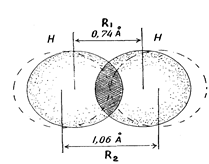
Рис. 11. Перекрывание электронных облаков

4. В образовании общих электронных пар по вышеописанному механизму могут участвовать только неспаренные электроны атомов (иначе говоря – только одноэлектронные облака). Например, изобразим образование молекулы F2 с помощью квантовых ячеек внешнего энергетического уровня (электронная формула атома F: 1s22s22p5):



 2s2 2p5 2p5 2s2 2s2 2p6 2p6 2s2
2s2 2p5 2p5 2s2 2s2 2p6 2p6 2s2
 | |||||||||
 |  |  | |||||||
 | |||||||||
















 ↑↓ ↑↓ ↑↓ ↑ + ↓ ↑↓ ↑↓ ↑↓ → ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑↓ ↑↓ ↑↓ ↑ + ↓ ↑↓ ↑↓ ↑↓ → ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
 |
F F
Неспаренные электроны 8ē 8ē
F2
Общая (поделенная) пара электронов
Спаренные электроны внешнего уровня атома для образования химических связей с другими атомами должны разъединяться (распариваться). Атом перейдет в новое валентное состояние. Затрата энергии на такой процесс возбуждения атома компенсируется энергией, выделяющейся при образовании химической связи (следует помнить, что возможности возбуждения атомов ограничены числом свободных орбиталей в соответствующих энергетических подуровнях).
5. Ковалентная связь обладает свойством насыщаемости, вследствие чего молекулы имеют вполне определенный состав.
Например, при образовании молекулы метана СН4 каждый из четырех неспаренных электронов возбужденного атома углерода соединился с электроном атома водорода, образовались 4 ковалентные связи; больше электронных пар в данном случае образоваться не может, молекулы СН5, СН6 и т. д. не существуют.
(Примечание: взаимодействие валентнонасыщенных соединений между собой возможно с образованием одной или нескольких дополнительных донорно-акцепторных связей по особому механизму).
6. Ковалентная связь направлена в пространстве, что обусловливает пространственную структуру молекул (свойство направленности).
В зависимости от того, какими электронами осуществляются связи – s-, р-, d- или f- электронами, существенно различны энергии связей, длины связей, а также их направление в пространстве.
Электронные облака имеют различную форму, поэтому их взаимное перекрывание осуществляется несколькими способами: различают s- (сигма), p- (пи) и d (дельта)-связи.

s-связь
Если перекрывание электронных облаков происходит вдоль линии, соединяющей ядра – это s-связь; если облака перекрываются вне этой линии, возникают p- и d-связи. Разновидности связи при комбинировании s-, р- и d-орбиталей показаны на рисунках:


p-связь d-связь
Если между атомами возникла одна общая электронная пара (обычно s-связь), такая связь называется одинарной, если две и более, то кратной: двойной, тройной.
Например, образование молекулы азота N2 осуществляется тремя общими электронными парами. У каждого атома азота в образовании связей участвует 3 неспаренных р-электрона, направленных в трехмерном пространстве под углом 900 друг к другу и ориентированных соответственно по осям х, у, z (таковы свойства р-подуровня и р-орбиталей, диктуемые магнитным квантовым числом).

Два атома азота, соединяясь в молекулу N2, могут образовать одну s-связь (перекрываются облака, ориентированные вдоль оси х) и две p-связи (перекрываются облака, ориентированные вдоль осей у и z).

Угловая конфигурация молекулы воды Н2O, определяющая ее высокую полярность и особенности свойств, связана с направлением в пространстве двух химических s-связей, в образовании которых участвовали два неспаренных р-электрона атома кислорода и по одному s-электрону атомов водорода.







 1s2 2s2 2p4
1s2 2s2 2p4
 H 8O ↑↑ ↑↓ ↑↓ ↑ ↑
H 8O ↑↑ ↑↓ ↑↓ ↑ ↑

σ 104,5˚
1s2

 0 σ H 1H ↑↑
0 σ H 1H ↑↑
Исходный угол в 90° между двумя р-орбиталями атома О увеличивается за счет взаимного отталкивания атомов Н, несущих избыток положительного заряда (вследствие смещения электронной плотности от Н к О).
Итак, структура молекул зависит прежде всего от вида и свойств тех орбиталей, которые атомы предоставляют для образования химических связей. Но, помимо этого фактора, на пространственное строение молекул влияет явление гибридизации орбиталей.
Гибридизацией называется образование новых равноценных по форме и энергии орбиталей из орбиталей разного типа. Смешанные, гибридные орбитали на схемах изображают условно:

Из одной s-орбитали и одной р-орбитали образуются две гибридные, смешанные орбитали sp-типа, направленные по отношению друг к другу на 180°

Из одной s-орбитали и двух р-орбиталей образуются три sp2-гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу:

sp3-гибридизация имеет место, если объединяются одна s-орбиталь и три р-орбитали; образуются четыре sp3-гибридные орбитали, ориентированные уже не в одной плоскости, а в объеме тетраэдра и направленные от центра тетраэдра к его 4 вершинам; валентный угол между двумя химическими связями составляет 109° 28¢

Возможны более сложные случаи гибридизации с участием d-электронов, (например, sp3d 2 - гибридизация).
Явление гибридизации, т.е. смешения, выравнивания электронной плотности, энергетически выгодно для атома, поскольку у гибридных орбиталей происходит более глубокое перекрывание и образуются более прочные химические связи. Небольшие затраты энергии на возбуждение атома и гибридизацию орбиталей с избытком компенсируются энергией, выделяющейся при возникновении химических связей. Валентные углы диктуются соображениями максимальной симметрии и устойчивости.
Примером sp3-типа гибридизации служит строение молекулы метана СН4. Атом углерода в возбужденном состоянии имеет четыре неспаренных электрона: один s- и три р-электрона. Казалось бы, четыре химические связи, образованные ими с s-электронами четырех атомов водорода, должны быть неравноценными. Однако экспериментально установлено, что все 4 связи в молекуле СН4 совершенно идентичны по длине и энергии, а углы между связями составляют 109°28¢. Следовательно, в молекуле СН4 имеет место sp3-гибридизация.

Другие примеры гибридизации: BeH2(sp-), BF3 (sp-2), РСl5(sp3d-) и др.
На гибридных орбиталях, как и на обычных орбиталях, может располагаться не только по одному электрону, но и по два. Например, четыре sp3-гибридные орбитали атома кислорода О таковы, что две из них содержат по паре электронов, а две – одному неспаренному электрону. С современных позиций строение молекулы воды рассматривается с учетом гибридизации орбиталей атома О и тетраэдрической структуры молекулы Н2O в целом.
4.5. Метод молекулярных орбиталей (ММО, МО). Хронологически метод МО появился позже метода ВС, поскольку оставались в теории ковалентной связи вопросы, которые не могли получить объяснение методом ВС. Укажем некоторые из них.
Как известно, основное положение метода ВС состоит в том, что связь между атомами осуществляется за счет электронных пар (связующих двухэлектронных облаков). Но это не всегда так. В ряде случаев в образовании химической связи участвуют отдельные электроны. Так, в молекулярном ионе Н2+ одноэлектронная связь. Метод ВС образование одноэлектронной связи объяснить не может, она противоречит его основному положению.
Метод ВС не объясняет также роли неспаренных электронов в молекуле. Молекулы, имеющие неспаренные электроны, парамагнитны, т. е. втягиваются в магнитное поле, так как неспаренный электрон создает постоянный магнитный момент. Если в молекулах нет неспаренных электронов, то они диамагнитны – выталкиваются из магнитного поля. Молекула кислорода парамагнитна, в ней имеется два электрона с параллельной ориентацией спинов, что противоречит методу ВС. Необходимо также отметить, что метод ВС не смог объяснить ряд свойств комплексных соединений – их цветность и др.
Чтобы объяснить эти факты, был предложен метод молекулярных орбиталей (ММО).
Поиск по сайту: