 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Процессы. Окислительно-восстановительными называют реакции, сопровождающиеся изменением степени окисления атомов
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ[2].
8.1 Степень окисления элементов. В простых веществах химическая связь - ковалентная неполярная. В двухцентровой двухэлектронной связи связывающая электронная пара симметрична и сосредоточена посредине межатомного расстояния. Оба взаимодействующих атома проявляют ковалентность, равную сумме порядков всех связей данного атома с другими атомами молекулы. Взаимодействующие атомы не имеют эффективных зарядов, связь неполярна, электровалентности атомов равны нулю.
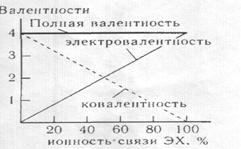 Если химическая связь образована двумя атомами с близкими электроотрицательностями, то также образуется ковалентная связь. Ковалентность также равна порядку связи, относящемуся к той его доле, которая соответствует неполярной ковалентной связи. Однако часть электронной плотности химической связи в некоторой мере смещена Рис.23. Изменение ковалентности и
Если химическая связь образована двумя атомами с близкими электроотрицательностями, то также образуется ковалентная связь. Ковалентность также равна порядку связи, относящемуся к той его доле, которая соответствует неполярной ковалентной связи. Однако часть электронной плотности химической связи в некоторой мере смещена Рис.23. Изменение ковалентности и
к более электроотрицательному атому. электровалентности центрального На этом атоме появляется эффективный атома идеализированной молекулы
отрицательный заряд, а на менее состава ЭХ4 в зависимости от ионности
электроотрицательном - эффективный, химической связи; атом Х одновалентный положительный заряд атома. Величина этого атом, типа Н, F и т.п.
заряда есть электровалентность атома. Значит, при повышении полярности атома убывает, а электровалентность – возрастает. В предельном случае полярной связи -ионной — связывающая электронная плотность полностью смещена к более электроотрицательномуатому. Эффективные заряды на взаимодействующих атомах приобретают мак симальные по модулю значения, а ковалентная составляющая связи отсутствует. Таким образом, в ионной связи ковалентность взаимодействующих атомов – равна нулю, а электровалентность достигает экстремальных значений (рис. 23).
Рис.23 построен на основании того, что ковалентность атома определяется неполярной составляющей химической связи, а электровалентность - эффективными зарядами атомов. Из рис.23 также видно, что, хотя ковалентность и электровалентности атомов изменяются различным образом, сумма ковалентности и модуля электровалентности, т. е. валентность атома остается постоянной.
Для уравнивания и определения вида возможных продуктов многих химических реакций существует специальный метод, основанный на понятии степени окисления. Для примера рассмотрим несколько соединений (табл. 20).
Таблица 20
Поиск по сайту: