 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Буферные растворы
|
Читайте также: |
Буферными называются растворы, незначительно изменяющие рН при добавлении небольших количеств сильной кислоты или сильного основания, а также при разбавлении. Чаще всего буферный раствор содержит два компонента, один из которых способен связывать катионы водорода, а другой - гидроксид-анионы. Например, механизм действия ацетатного буфера (CH3COOH + CH3COONa) может быть описан следующим образом. При добавлении небольшого количества щелочи последняя нейтрализуется кислотой по уравнению:
CH3COOH + NaOH ® CH3COONa + H2O
Добавление сильных кислот приводит к вытеснению уксусной кислоты из её соли. Так как уксусная кислота является кислотой слабой, рН раствора практически не изменяется:
CH3COONa + HCl ® CH3COOH + NaCl
Количество кислоты или основания, необходимое для изменения pH одного литра буферного раствора на единицу, называется его буферной емкостью.
Буферным действием могут обладать также растворы амфотерных веществ (амфолитов), содержащих два вида функциональных групп, способные связывать катионы водорода и реагирующие с гидроксид-анионами. К соединениям такого рода относятся аминокислоты, например, глицин (аминоуксусная кислота).
H2N-CH2-COOH + HCl ® Cl-H3N+-CH2-COOH
H2N-CH2-COOH + NaOH ® H2N-CH2-COOH + H2O
Большой буферной емкостью обладают белки и полипептиды, содержащие свободные амино- и карбоксильные группы. Буферные системы играют очень важную роль в биохимии живых организмов, поскольку ферменты очень чувствительны к изменению кислотности среды.
Рассмотрим примеры расчета pH кислотного и основного буферного раствора.
Пример № 1. Ацетатный буфер (0,01М CH3COOH + 0,01 М CH3COONa). Кислотность данного раствора обусловлена диссоциацией уксусной кислоты
CH3COOH  CH3COO- + H+
CH3COO- + H+
 = 1,75×10-5
= 1,75×10-5
Наличие в растворе ацетата натрия практически полностью подавляет данный процесс в соответствие с принципом Ле Шателье. В свою очередь, присутствие в растворе уксусной кислоты подавляет гидролиз ацетат-аниона, поэтому в первом приближении
[CH3COOH] = Ск-ты; [CH3COO-] = Ссоли
Подставим данные величины в константу диссоциации кислоты и преобразуем полученное выражение:
 ; отсюда
; отсюда  ;
;
pH = -lg[H+] = pK + lg  = 4,75
= 4,75
Поскольку в полученную формулу входит отношение концентраций компонентов раствора, его pH не должен изменяться при разбавлении.
Пример № 2. Аммиачный буфер (0,01М NH3×H2O + 0,01М NH4Cl). Кислотность, точнее основность, данного раствора определяется ионизацией аммиака.
NH3×H2O  NH4+ + OH-
NH4+ + OH-
 = 1,8×10-5
= 1,8×10-5
Так как [NH4+] = Cсоли, а [NH3×H2O] = Сосн,, то
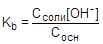 , отсюда
, отсюда 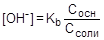 ;
;
pOH = - lg[OH-] = pKb - lg(Сосн/Cсоли)
pH = 14 - pKb + lgСосн - lgCсоли = 14 - 4,76 = 9,24
Лекция 29. Теории кислот и оснований
Кислоты и основания - классы химических соединений, отличительным признаком которых является их способность реагировать друг с другом, вступая в кислотно-основное взаимодействие. Однако вплоть до настоящего времени нет единого мнения о том, какие признаки являются необходимыми и достаточными для отнесения того или иного процесса к кислотно-основному взаимодействию, в связи с чем нет и единой теории кислот и оснований. Ниже рассмотрены наиболее важные теории кислот и оснований, к которым следует отнести ионную теорию Аррениуса, теорию сольвосистем Франклина, протолитическую теорию Бренстеда-Лоури и электронную теорию Льюиса. Каждая из этих теорий по-разному определяет понятия кислота и основание.
1. Ионная теория кислот и оснований (С. Аррениус, 1887 г.).
Ионная теория связывает отнесение электролитов к кислотам и основаниям с характером диссоциации этих соединений. В соответствии с этой теорией кислотам и основаниям даются следующие определения:
Кислота - это электролит, отщепляющие при диссоциации в качестве катионов только ионы водорода, например,
HCl = H+ + Cl-,
СН3СООН  Н+ + СН3СОО-
Н+ + СН3СОО-
Основание - это электролит, отщепляющий при диссоциации в качестве аниона толькогидроксид- анионы, например,
NaOH = Na+ + OH-,
Ca(OH)2  Ca2+ + 2OH-
Ca2+ + 2OH-
Общие свойства, присущие кислотам (способность определенным образом изменять окраску индикаторов, вступать в реакцию нейтрализации, реагировать с некоторыми металлами с выделением водорода), согласно ионной теории - это фактически свойства, присущие катиону водорода в растворе. Именно этот ион вступает в реакцию нейтрализации
Н+ + ОН- = Н2О
и обусловливает растворение металлов в кислотах по уравнению
M + nH+ = Mn+ +  H2
H2
Точно так же общие свойства оснований - это свойства присутствующих в растворе ионов гидроксила.
Ионная теория впервые объяснила явление амфотерности. Согласно этой теории соединениям типа R-O-H в зависимости от прочности связей R-О и О-Н присущи три типа диссоциации. Если связь R-О прочнее связи О-Н, диссоциация электролита протекает по уравнению
R-O-H  H+ + RO-
H+ + RO-
и соединение является кислотой. Если связь R-О менее прочна, чем связь О-Н, то электролит диссоциирует по уравнению
R-O- H  R+ +OH-
R+ +OH-
и является основанием. В тех же случаях, когда связи R-O и О-Н близки по прочности, электролит диссоциирует по обоим уравнениям:
H+ + RO-  R-O-H
R-O-H  R+ +OH-
R+ +OH-
Если к раствору такого электролита добавить кислоту, то ионы водорода будут связывать ионы гидроксила в молекулы воды и равновесие сместится в сторону второй реакции, и электролит будет функционировать как основание. При введении в систему основания, ионы гидроксила будут связывать ионы водорода, что приведет к смещению равновесия в сторону первой реакции, в которой электролит выступает как кислота. Подобные электролиты, проявляющие в зависимости от условий свойства и кислот, и оснований, называют амфотерными.
Идеальным амфотерным электролитом, хотя и очень слабым, является вода, диссоциирующая по уравнению
Н2О  Н+ + ОН-
Н+ + ОН-
и отщепляющая ионы, характерные как для кислоты, так и для основания.
Ионная теория удовлетворительно объясняет процессы кислотно-основного взаимодействия в водных растворах, но не пригодна для описания таких процессов в неводных средах. В рамках этой теории затруднительно объяснить, почему хлорид аммония в растворах отчетливо проявляет свойства кислоты (вступает в реакцию нейтрализации, реагирует с магнием с выделением водорода), а аммиак, не содержащий гидроксильных групп, по свойствам является типичным основанием.
2. Теория сольвосистем (Э. Франклин, 1914 г.).
Теория сольвосистем позволяет распространить ионную теорию на неводные системы с самоионизирующимися растворителями.
Сопоставим уравнения диссоциации воды, типичной кислоты и типичного основания
H2O + H2O  H3O+ + OH-;
H3O+ + OH-;
HCl + H2O  H3O+ + Cl-;
H3O+ + Cl-;
NaOH  Na+ + OH-
Na+ + OH-
Как следует из приведенных уравнений, кислота при диссоциации в водном растворе образует тот же катион, что и вода, а основание - тот же анион. Этот признак кислот и оснований лежит в основе теории сольвосистем, определяющей понятия кислота и основание следующим образом.
Кислота - это вещество, отщепляющее в растворе тот же катион, что и диссоциирующий растворитель.
Основание - это вещество, отщепляющее в растворе тот же анион, что и диссоциирующий растворитель.
Кислота и основание в сольвосистемах способны взаимно нейтрализовать друг друга по схеме:
кислота + основание = соль + растворитель
Так, например, жидкий аммиак диссоциирует по уравнению
NH3 + NH3  NH
NH  + NH
+ NH  ,
,
отщепляя катион аммония и дигидронитрид-анион. Соответственно соединения, отщепляющие при растворении в жидком аммиаке ионы NH4+, будут проявлять свойства кислот, а ионы NH2- - свойства оснований. Примером такой кислоты может служить хлорид аммония, диссоциирующий по уравнению
NH4Cl  NH
NH  + Cl-,
+ Cl-,
а примером основания - дигидронитрид (амид) натрия. Как кислота и основание, хлорид аммония и дигидронитрид натрия способны вступать в реакцию нейтрализации
NH4Cl + NaNH2  NaCl + 2NH3
NaCl + 2NH3
Весьма интересным самоионизирующимся растворителем является жидкий фтороводород, диссоциирующий по уравнению
3HF  H2F+ + HF
H2F+ + HF 
В жидком фтороводороде свойствами кислоты будут обладать такие соединения, как трифторид бора и пентафторид сурьмы, которые диссоциируют по уравнениям
BF3 + 2HF  H2F+ + [BF4]-,
H2F+ + [BF4]-,
SbF5 + 2HF  H2F+ + [SbF6]-
H2F+ + [SbF6]-
Свойства оснований в рассматриваемом растворителе будут проявлять такие вещества, как хлороводород и азотная кислота:
HCl + 2HF  H2Cl+ + HF
H2Cl+ + HF  ,
,
HNO3 + 2HF  H2NO3+ + HF
H2NO3+ + HF 
Теория сольвосистем включает ионную теорию кислот и оснований как частный случай, в котором растворителем является вода.
3. Протолитическая теория кислот и оснований (Й. Бренстед, Т. Лоури, 1923 г.).
Согласно протолитической теории сущность кислотно-основного взаимодействия состоит в передаче протона кислотой основанию, соответственно чему понятиям кислота и основание даются следующие определения:
кислота - это соединение, которое в кислотно-основной реакции является донором протона;
основание - это соединение, которое в кислотно-основной реакции является акцептором протона.
Реакция передачи протона кислотой основанию называется протолитической реакцией. Для кислоты НА и основания В она протекает по уравнению
НА + В  А- + ВН+
А- + ВН+
а1 b2 b1 а2
При этом кислота, потерявшая протон, превращается в частицу, потенциально способную протон присоединять, т.е. в новое основание. Аналогично основание, присоединившее протон, превращается в новую кислоту. Кислота и основание, образовавшееся из этой кислоты после ее депротонирования, называются сопряженными. Так сопряженными кислотами и основаниями являются пары НА и А-, ВН+ и В. Часто сопряженные кислоту и основание обозначают символами a и b (от acidum - кислота и base - основание) с одинаковыми индексами. Константа равновесия процесса

называется константой протолиза.
В качестве примера рассмотрим в рамках протолитической теории взаимодействие уксусной кислоты с аммиаком
CH3COOH + NH3  NH
NH 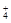 + CH3COO-
+ CH3COO-
а1 b2 a2 b1
В этой реакции СН3СООН выступает как донор протона и является кислотой; сопряженным с ней основанием будет ацетат-ион. Присоединяющий протон аммиак играет роль основания; он превращается в сопряженную кислоту - ион аммония.
В качестве кислот и оснований Бренстеда могут выступать молекулы, катионы и анионы. Соответственно этому кислоты Бренстеда делятся на нейтральные (например, СН3СООН), катионные (например, NH4+) и анионные (например, НSО4-). Ниже приведены уравнения диссоциации этих кислот:
CH3COOH + H2O  H3O+ + CH3COO-;
H3O+ + CH3COO-;
а1 b2 a2 b2
NH 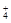 + H2O
+ H2O  H3O+ + NH3;
H3O+ + NH3;
a1 b2 a2 b1
HSO4- + H2O  H3O+ + SO
H3O+ + SO 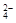
a1 b2 a2 b1
На аналогичные классы могут быть подразделены и основания. Примером нейтральных оснований может служить аммиак, катионных - ион гидразония N2Н5+, анионных - карбонат-ион. Эти соединения являются акцепторами протонов по уравнениям:
NH3 + H2O  NH4+ + OH-;
NH4+ + OH-;
b1 a2 a1 b2
N2H5+ + H2O  N2H6 + OH-;
N2H6 + OH-;
b1 a2 a1 b2
CO  + H2O
+ H2O  HCO3-+ OH-
HCO3-+ OH-
b1 a2 a1 b2
Несомненным достоинством протолитической теории является то, что она позволяет количественно охарактеризовать силу кислот и оснований, используя константы равновесия соответствующих реакций. Пусть в растворе кислоты НА имеет место равновесие
НА + Н2О  Н3О+ + А-
Н3О+ + А-
Сила кислоты тем больше, чем больше константа равновесия
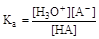
(концентрация воды в растворе может считаться постоянной и входит в значение константы Ка). Константу Ка называют константой кислотности. Аналогично для основания В, диссоциирующего по уравнению
В + Н2О  ВН+ + ОН-
ВН+ + ОН-
константа равновесия

называемая константой основности, характеризует силу основания, которая тем больше, чем больше значение Кb.
Для оценки силы кислот и оснований часто используют отрицательный десятичный логарифм константы кислотности или основности (показатель константы)
pKa = -lgKa; pKb = -lgKb
Чем сильнее кислота или основание, тем меньше значение pKa или pKb.
Протолитическая теория может быть распространена и на неводные растворы. Например, взаимодействие циановодорода с амидом калия в жидком аммиаке сводится к протолитической реакции
HCN + NH  = NH3 + CN-
= NH3 + CN-
a1 b2 a2 b1
причем циановодород в этих условиях проявляет свойства сильной кислоты.
Протолитическая теория кислот и оснований является более широким обобщением, чем ионная теория и теория сольвосистем. В то же время этой теории присущи и некоторые ограничения: в рамках рассматриваемой теории к кислотам могут быть отнесены лишь протонсодержащие соединения.
4. Электронная теория кислот и оснований (Г. Льюис, 1926 г.).
Согласно электронной теории кислотно-основное взаимодействие сводится к образованию между кислотой и основанием ковалентной связи по донорно-акцепторному механизму. В рамках данной теории
кислота - это соединение, которое в кислотно-основном взаимодействии является акцептором электронной пары;
основания - это соединения, которые в кислотно-основном взаимодействии являются донором электронной пары.
Взаимодействие кислоты и основания по электронной теории сопровождается образованием солеподобного соединения, называемого аддуктом. Многие аддукты устойчивы и могут быть выделены как индивидуальные соединения; некоторые аддукты существуют только в растворах.
Электронная теория позволяет распространить представления о кислотно-основном взаимодействии на очень широкий круг соединений и химических реакций. В соответствии с этой теорией кислотами могут быть весьма разнообразные вещества. Ниже приведены важнейшие группы кислот Льюиса и примеры кислотно-основных реакций с их участием.
1. Протон Н+:
Н+ + ОН- = НОН
кислота основание аддукт
2. Катионы - центральные атомы в комплексах (Ag+, Cu2+, Al3+ и др.):
Cu2+ + 4NH3 = [Cu(NH3)4]2+,
кислота основание аддукт
Al3+ + 6F- = [AlF6]3-,
кислота основание аддукт
3. Галогениды и псевдогалогениды, в которых не реализовано высшее значение координационного числа (SnCl4, BF3, Hg(CN)2 и др.):
SnCl4 + 2Cl- = [SnCl6]2-;
кислота основание аддукт
BF3 + NH3 = F3BNH3;
кислота основание аддукт
Hg(CN)2 + 2CN- = [Hg(CN)4]2-
кислота основание аддукт
4. Оксиды с двойными и тройными связями, у которых атом с наименьшей электроотрицательностью может быть акцептором (CO2, SO2, SO3 и др.):
SO3 + H2O  H2SO4,
H2SO4,
кислота основание аддукт
СO2 + H2O  HCO3-
HCO3-
кислота основание аддукт
5. Амфотерные гидроксиды при взаимодействии с сильными основаниями (Al(OH)3, Sn(OH)2, Cr(OH)3 и др.):
Al(OH)3 + 3OH-  [Al(OH)6]3-
[Al(OH)6]3-
кислота основание аддукт
В качестве оснований Льюиса могут выступать как молекулы с неподеленными парами на гибридных орбиталях (H2O, NH3, N2H4), так и лиганды-анионы в координационных соединениях (OH-, F-, CN-). Таким образом, электронная теория рассматривает реакции комплексообразования как кислотно-основные процессы.
Следует, однако, отметить, что кислоты Бренстеда не могут быть причислены к кислотам Льюиса, так как при протекании протолитической реакции образуются новая кислота и основание, а не аддукт. Теория Льюиса рассматривает кислоты Бренстеда как продукты нейтрализации протона основанием, т.е. как аддукты, а протолитическую реакцию как процесс вытеснения основания А- более сильным основанием В. Например, в случае реакции
NH4+ + OH-  NH3 + H2O
NH3 + H2O
NH4+ рассматривается как аддукт, образующийся при нейтрализации H+ основанием NH3, а сама реакция трактуется как процесс вытеснения основания NH3 более сильным основанием ОН-.
Протолитическая и электронная теории взаимно дополняют друг друга, однако при использовании их всегда необходимо указывать, какие кислоты и основания, Бренстеда или Льюиса, имеются в данный момент в виду.
Лекция 30. Окислительно-восстановительные реакции в растворах
Поиск по сайту: