 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Периодической системы
Свойства химических элементов могут быть подразделены на непериодические и периодические. Непериодические свойства с возрастанием порядкового номера элемента изменяются более или менее монотонно на протяжении всего ряда элементов. Примером подобных свойств могут служить атомная масса элемента и длины волн характеристических линий рентгеновских спектров. Периодические свойства в значительной мере определяются электронной конфигурацией атома, которая, изменяется периодически. Подобные свойства изменяются относительно монотонно на протяжении периода; переход же к следующему периоду сопровождается скачкообразным изменением свойства. К периодическим свойствам относятся такие физические характеристики, как эффективный заряд ядра, радиус атома, энергия ионизации, сродство к электрону, электроотрицательность. Периодически изменяются также химические свойства элементов, однако сопоставление их затруднено отсутствием соответствующих количественных характеристик.
Поскольку периодические свойства зависят не только от типа заполняемых электронами валентных энергетических подуровней и числа электронов на этих подуровнях, изменения свойств элементов даже в пределах периода или подгруппы зачастую отклоняются от строгой монотонности и носят скорее характер определенной тенденции. Нарушение монотонного изменения тех или иных характеристик атомов в горизонтальных рядах p-, d- и f-элементов получило название внутренней периодичности; нарушение монотонности изменения свойств в подгруппах элементов называется вторичной периодичностью. Причины, обуславливающие вторичную и внутреннюю периодичность, будут рассмотрены ниже.
Эффективный заряд ядра
Эффективный заряд ядра (Zэфф) - это заряд, соответственно которому ядро действует на валентные электроны. При расчете эффективного заряда ядра учитываются эффекты экранирования и проникновения электрона к ядру. Эффективный заряд совпадает с истинным лишь для водорода и одноэлектронных ионов, для всех остальных атомов эффективный заряд меньше порядкового номера.
Эффект экранирования зависит от типа орбитали, занятой электроном. Наиболее слабо экранируют ядро валентные электроны внешнего электронного слоя, наиболее сильно - электроны внутренних электронных слоев. При перемещении по периоду слева направо истинный заряд ядра увеличивается от элемента к элементу на единицу, тогда как электроны, поступающие, во внешний электронный слой или на d-подуровень предвнешнего слоя (в случае d-элементов больших периодов) понижают эффективный заряд ядра меньше, чем на единицу. Таким образом, в периодах с увеличением порядкового номера эффективные заряды ядра должны расти. После завершения периода очередной электрон поступает на следующий энергетический уровень, начинает строиться новый электронный слой, внешние электроны становятся предвнешними, их экранирующее действие возрастает и эффективный заряд ядра понижается. В табл. 3 приведены значения Zэфф для элементов II периода.
Таблица 3
Свойства элементов II периода (Zэфф - эффективный заряд ядра, rорб - орбитальный радиус атома, I - энергия ионизации, Еэл - сродство к электрону, c - электроотрицательность по Полингу)
| Элемент | Zэфф, эл.ед. | rорб, пм | I1, эВ/ат | Еэл, эВ/ат | c |
| Li | 1,28 | 5,19 | 0,62 | 0,98 | |
| Be | 1,98 | 9,32 | 1,57 | ||
| B | 2,42 | 8,30 | 0,28 | 2,04 | |
| C | 3,14 | 11,26 | 1,27 | 2,56 | |
| N | 3,83 | 14,53 | -0,07 | 3,04 | |
| O | 4,45 | 13,62 | 1,46 | 3,44 | |
| F | 5,10 | 17,42 | 3,40 | 3,98 | |
| Ne | 5,76 | 21,56 | - |
Как следует из данных таблицы, для элементов в пределах малых периодов значения Zэфф с увеличением порядкового номера монотонно возрастают (рис. 3).

Рис. 3. Изменение эффективного заряда ядра в пределах второго периода
В подгруппах периодической системы от элемента к элементу возрастает главное квантовое число валентных энергетических подуровней. С повышением главного квантового числа экранирующее действие валентных электронов несколько понижается. В результате в А- и В-подгруппах эффективные заряды ядер должны расти с увеличением порядкового номера элемента. Значения Zэфф для элементов подгрупп IVA, VIA и IB, IVB, приведенные в табл. 4 и 5, подтверждают это заключение. Внутренняя и вторичная периодичность для эффективных зарядов ядер не проявляются (рис. 3 и 4.)
Таблица 4
Свойства элементов подгрупп IVA и VIA (обозначения те же, что и в табл. 3)
| Под-группа | Элемент | Zэфф, эл.ед. | rорб, пм | I1, эВ/ат | Еэл, эВ/ат | c |
| IVA | C | 3,14 | 11,26 | 1,27 | 2,55 | |
| Si | 4,29 | 8,15 | 1,38 | 1,90 | ||
| Ge | 6,78 | 7,90 | 1,24 | 2,01 | ||
| Sn | 9,11 | 7,34 | 1,25 | 1,80 | ||
| Pb | 12,39 | 7,42 | 1,14 | 1,87 | ||
| VIA | O | 4,45 | 13,62 | 1,46 | 3,44 | |
| S | 5,46 | 10,36 | 2,08 | 2,58 | ||
| Se | 8,29 | 9,75 | 2,02 | 2,55 | ||
| Te | 10,81 | 9,01 | 1,97 | 2,10 | ||
| Po | 14,22 | 8,43 | 1,87 | 2,00 |

Рис. 4. Изменение эффективного заряда ядра в пределах VIA-группы
Таблица 3
Свойства элементов подгрупп IB и VIB (rмет - металлический радиус атома; остальные обозначения те же,
что и в табл. 3)
| Под-группа | Эле- мент | Zэфф, эл.ед. | rорб, пм | rмет, пм | I1, эВ/ат | Еэл, эВ/ат | c |
| IB | Cu | 5,84 | 7,73 | 1,23 | 1,90 | ||
| Ag | 8,03 | 7,58 | 1,30 | 1,93 | |||
| Au | 10,94 | 9,23 | 2,31 | 2,54 | |||
| IVB | Ti | 4,82 | 6,82 | 0,21 | 1,54 | ||
| Zr | 6,45 | 6,83 | 0,52 | 1,33 | |||
| Hf | 9,16 | 7,50 | 1,30 |
Атомные радиусы
Поскольку атом не имеет определенных размеров, атомные радиусы представляют собой в известной мере условные величины. Различают орбитальные и эффективные атомные радиусы.
Орбитальные радиусы (rорб) - это расстояния от ядра до главного максимума функции радиального распределения электронной плотности. Эти величины рассчитаны квантово-механическими методами для всех элементов периодической системы.
Эффективные радиусы (rэфф), в отличие от орбитальных, определяют экспериментально из значений межъядерных расстояний в молекулах или в кристаллах. При этом предполагается, что межъядерное расстояние равно сумме эффективных радиусов соседних атомов (одинаковых для простых веществ, разных - для сложных). Совершенно очевидно, что эффективные атомные радиусы в этом случае будут зависеть не только от природы элемента, но и от типа химической связи в молекуле или в кристалле. Соответственно различают ковалентные, ионные, металлические и ван-дер-ваальсовские радиусы, отвечающие агрегатам с ковалентной, ионной, металлической связью и с межмолекулярным взаимодействием (например, кристаллам благородных газов). Естественно, что тип связи в кристалле весьма сильно влияет на значение эффективного радиуса. Поэтому при сопоставлении элементов с разными типами связи в кристаллах простых веществ рационально использовать орбитальные радиусы, не зависящие от типа связи. Если в рассматриваемых совокупностях элементов тип связи одинаков (например, для металловВ-подгрупп), сопоставление эффективных радиусов также позволяет выносить весьма ценные заключения.
На атомные радиусы элементов оказывают влияние следующие факторы:
1. Эффективный заряд ядра. Увеличение Zэфф при прочих равных условиях усиливает притяжение валентных электронов к ядру и, следовательно, уменьшает радиус.
2. Число энергетических уровней, заполненных электронами. Увеличение числа электронных слоев атома способствует увеличению его радиуса.
3. Электронная конфигурация атома. Заполнение валентными электронами соответствующих энергетических подуровней делает атом более компактным, уменьшая его радиус. Можно ожидать, что наибольшее влияние на радиус будет оказывать образование электронных структур ns2, np6, nd10, nf14 и, в меньшей степени, np3, nd5, nf7. С другой стороны, заполнение электронами внутренних d- и f-подуровней благоприятствует проникновению валентных электронов к ядру. Образующиеся при этом d10 и f14 экраны как бы "придавливают" проникающий под них электрон к ядру, понижая его энергию и уменьшая радиус атома.
Проанализируем закономерности изменения атомных радиусов в периодической системе элементов. В периодах число электронных слое не изменяется, а эффективный заряд ядер растет. Можно ожидать, что в периодах слева направо будет наблюдаться тенденция к уменьшению атомных радиусов. Действительно, как следует из табл. 1, для элементов II периода по ряду Li - Ne орбитальные радиусы атомов последовательно понижаются от 159 пм у лития до 35 пм у неона без каких-либо нарушений монотонности (рис. 5).

Рис. 5. Изменение орбитального радиуса в пределах второго периода
Несколько сложнее изменение атомных радиусов в больших периодах. Так, в IV периоде атомные радиусы монотонно уменьшаются по рядам s-элементов (К - Са) и d-элементов (Sc - Zn) с незначительными отклонениями у хрома и меди, возможно, обусловленными провалом электрона. Далее наблюдается нарушение монотонности: радиус атома галлия (электронная формула [Ar]183d10 4s24p1) значительно больше атомного радиуса предшествующего ему цинка (электронная формула [Ar]183d10 4s2). Это явление можно объяснить, с одной стороны, завершением формирования у цинка подуровня 3d10, а с другой - появлением у галлия структуры 4s24p1, способствующей увеличению радиуса атома. В ряду Ga - Kr радиусы атомов р-элементов монотонно уменьшаются. По аналогичной схеме изменяются радиусы атомов элементов V периода.
Для VI периода наблюдается резкое уменьшение радиуса при переходе от элемента IIIB-подгруппы к элементу IVB-подгруппы: если в V периоде орбитальный радиус иттрия отличается от орбитального радиуса циркония на 10 пм, то для лантана и гафния разность атомных радиусов составляет 44 пм. Это явление связано с тем, что в IV периоде между лантаном и гафнием "вклиниваются" 14 элементов - лантаноидов, по ряду которых атомные радиусы уменьшаются от 198 пм (церий) до 155 пм (лютеций). Уменьшение атомных радиусов в ряду лантаноидов называют лантаноидным сжатием или лантаноидной контракцией. Лантаноидная контракция имеет большое значение для объяснения закономерностей изменения свойств элементов.
Рассмотрим характер изменения атомных радиусов в подгруппах периодической системы. При перемещении по подгруппе сверху вниз растет число электронных слоев, на которых распределяются электроны, что должно сопровождаться увеличением атомных радиусов. В то же время возрастание эффективного заряда ядер в подгруппах способствует уменьшению радиусов атомов, аналогичное влияние на радиус оказывает также и формирование d10- и f14-экранов. В А-подгруппах периодической системы число электронных слоев является определяющим фактором: в подгруппах s- и р-элементов наблюдается явная тенденция к увеличению атомных радиусов с возрастанием порядкового номера элемента. Так, в подгруппе VIA (табл. 6.) атомные радиусы монотонно возрастают от кислорода (rорб = 45 пм) до полония (rорб = 121 пм).

Рис. 6. Изменение орбитального радиуса в пределах VIA-группы
Для В-подгрупп периодической системы на характер изменения атомных радиусов существенное влияние оказывает лантаноидная контракция, приводящая к уменьшению атомного радиуса третьего элемента подгруппы, относящегося к VI периоду, сравнительно с ожидаемой величиной. В табл. 3 приведены орбитальные и металлические радиусы элементов подгрупп IB и IVB. Для обеих подгрупп переход от первого элемента ко второму сопровождается увеличением атомного радиуса, тогда как при переходе от второго элемента к третьему металлические радиусы практически не изменяются, а орбитальные даже уменьшаются.
Энергия ионизации
Энергия ионизации - это количество энергии, необходимое для отрыва электрона от атома или иона данного элемента. Различают первую, вторую, третью и т.д. энергии ионизации, соответствующие удалению первого, второго, третьего и т.д. электрона атомной частицы. Энергию ионизации обозначают символом I n (n = 1,2,3...) и выражают в эВ/атом или в кДж/моль. Напомним, что 1 эВ º 1,60219×10-19 Дж; в расчете на 1 моль атомов это составляет 96,486 кДж/моль.
Энергия ионизации является сложной функцией ряда характеристик атома. Повышению энергии ионизации способствует увеличение эффективного заряда ядра, наличие в атоме полностью или наполовину заполненных валентными электронами энергетических подуровней, уменьшение радиуса атома, формирование экранов, усиливающих проникновение валентных электронов к ядру.
В периодах, как было показано выше, с увеличением порядкового номера элемента эффективный заряд ядер растет, а атомные радиусы уменьшаются, следовательно, в периодах энергия ионизации должна проявлять тенденцию к увеличению, однако меняющиеся электронные структуры атомов будут нарушать монотонность изменения этого свойства. Этот вывод хорошо согласуется с экспериментальными данными. Так, для элементов II периода (табл. 3) тенденция к возрастанию первой энергии ионизации очевидна: для лития значение I1 равно 5,39 эВ/атом, а для неона 21,56 эВ/атом. Однако монотонность изменения свойства нарушается при переходе от бериллия к бору и от азота к кислороду. Это явление связано с появлением заполненного 2s-подуровня у бериллия (1s22s2) и наполовину заполненного 2р-подуровня у азота (1s22s22p3); эти структуры отличаются повышенной устойчивостью, что затрудняет отрыв электрона от атомов бериллия и азота. В результате в ряду р-элементов II периода проявляется внутренняя периодичность (рис. 7).

Рис. 7. Изменение первого потенциала ионизации в пределах второго периода
В А-подгруппах периодической системы сверху вниз увеличиваются атомные радиусы элементов, откуда можно ожидать, что энергии ионизации в А-подгруппах будут уменьшаться, хотя возможность вторичной периодичности для данного свойства не исключается. Действительно, для элементов подгруппы VIA значения первой энергии ионизации монотонно уменьшаются, а в IVA-подгруппе I1 убывает от углерода к кремнию, незначительно понижается при переходе от кремния к германию, заметно уменьшается у олова и несколько увеличивается у свинца (табл. 4).
Для подгрупп d-элементов изменение энергии ионизации носит более сложный характер. В связи с лантаноидной контракцией, приводящей к уменьшению атомных радиусов элементов VI периода, и сформированным у этих элементов 4f-экраном у третьих элементов В-подгрупп наблюдается значительное увеличение энергии ионизации. В качестве примера в табл. 5 рассмотрены изменения I1 для подгрупп IB и IVB; как следует из приведенных данных значения энергии ионизации для первого и второго элементов подгрупп близки, а для третьего - возрастают.
Сродство к электрону
Сродство к электрону (Еэл) - это энергетический эффект присоединения электрона к атомной частице. Как и энергия ионизации, сродство к электрону выражается либо в эВ/атом, либо в кДж/моль. К сожалению, эта характеристика атомов вплоть до настоящего времени с достаточной надежностью определена далеко не для всех элементов. Сродство к электрону относительно точно можно определить для неметаллов, образующих отрицательные ионы: сродство к электрону для такого элемента будет равно по абсолютной величине и обратно по знаку энергии ионизации однозарядного отрицательного иона. Для металлов, не образующих отрицательных ионов, сродство к электрону устанавливают приближенно косвенными и не всегда надежными методами. В результате для ряда металлов значения сродства к электрону до сих пор не определены с достаточной достоверностью, что существенно затрудняет анализ закономерностей изменения этого свойства элементов.
Можно ожидать, что возрастанию сродства к электрону будет способствовать увеличение эффективного заряда ядра и степени устойчивости электронных конфигураций, образующихся после присоединения к атому электрона. Можно предположить, что характер изменения сродства к электрону в периодах и подгруппах схож с изменением энергии ионизации с той разницей, что элементам с устойчивыми конфигурациями типа s2, p6, p3, d10, d5 и т.д., будут отвечать особо низкие значения Еэл, а наибольшие значения этого свойства будут присущи конфигурациям, на один электрон отстающим от устойчивых.
В табл. 3 сопоставлены значения Еэл для элементов II периода. Как следует из таблицы, нулевые и отрицательные значения сродства к электрону отвечают бериллию, азоту и неону, в атомах которых сформированы устойчивые конфигурации 2s2, 2p3 и 2p6; для остальных элементов прослеживается отчетливая тенденция к возрастанию Еэл с увеличением порядкового номера. Максимальное значение Еэл отвечает фтору - элементу, которому недостает одного электрона для приобретения устойчивой конфигурации благородного газа (рис. 8).
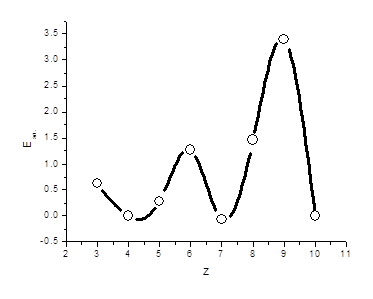
Рис. 8. Изменение сродства к электрону в пределах второго периода
В А-подгруппах сродство к электрону уменьшается с увеличением порядкового номера элемента, хотя и не строго монотонно, что может быть проиллюстрировано данными табл. 2, в которой приведены значения Еэл элементов подгрупп IVA и VIA. Из общей закономерности здесь выпадают углерод и кислород - элементы, открывающие подгруппы. Анализ изменения Еэл в В-подгруппах затрудняет отсутствие надежных данных о значениях сродства к электрону для многих d-элементов. Для некоторых В-подгрупп зарегистрировано увеличение сродства к электрону с возрастанием порядкового номера; для других подгрупп значение Еэл проходит через максимум (табл. 5).
Электроотрицательность
Электроотрицательность элемента - это характеристика, определяющая способность его атома притягивать к себе электроны, участвующие в образовании химических связей.
Существует ряд методов количественной оценки электроотрицательности, из которых наиболее популярным является метод, предложенный Л. Полингом и основанный на сопоставлении энергий связей между одинаковыми и различными атомами.
Пусть атомы А и В образуют гомоядерные двухатомные молекулы (А2 и В2) и гетероядерную молекулу АВ. Если электроотрицательности атомов А и В (cА и cВ) равны, то общая электронная пара в молекуле АВ в равной мере принадлежит обоим атомам. Полинг предположил, что в этом случае энергия связи А-В (ЕАВ) должна равняться среднему геометрическому энергий связи в молекулах А2 и В2, а

Если же DЕ не равно нулю, то это свидетельствует о том, что электроотрицательности А и В не одинаковы. Связь между электроотрицательностями элементов и величиной DЕ выражается уравнением

Приняв электроотрицательность фтора равной 4, Полинг рассчитал относительные значения электроотрицательности для большинства химических элементов.
Очень простой прием расчета абсолютных значений электроотрицательности был предложен Р. Малликеном. По Малликену электроотрицательность элемента равна полусумме первой энергии ионизации и сродства к электрону для этого элемента

Однако, как уже указывалось, значения Еэл известны не для всех элементов, что ограничивает использование абсолютных величин электроотрицательности.
Сопоставление электроотрицательности элементов в периодах и подгруппах показывает, что она является периодическим свойством. В периодах значения электроотрицательности возрастают. Это обусловлено тем, что электроотрицательность тем больше, чем прочнее удерживает атом собственный электрон, мерой чего является энергия ионизации, и чем активнее он присоединяет электрон извне, мерой чего является сродство к электрону. В периодах же слева направо наблюдается тенденция к увеличению как I, так и Еэл. В табл. 3 приведены значения электроотрицательности элементов II периода.

Рис. 9. Изменение электроотрицательности в пределах второго периода
В А-подгруппах по тем же причинам значения электроотрицательности с ростом порядкового номера убывают, хотя возможны и некоторые нарушения монотонности, связанные со вторичной периодичностью (рис. 10).
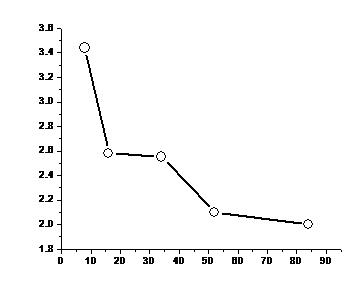
Рис. 10. Изменение электроотрицательности в пределах VIA-группы
В подгруппах d-элементов прогнозирование характера изменения электроотрицательности встречает серьезные затруднения. Как видно из табл. 3, значения электроотрицательности в В-подгруппах могут как уменьшаться (подгруппа IVB), так и и увеличиваться (подгруппа IB) с увеличением порядкового номера.
Поиск по сайту: