 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Химическая кинетика и химическое равновесие
Активированный комплекс - ассоциат частиц, участвующих в химической реакции, в котором синхронно происходит разрыв старых и образование новых связей.
Закон действующих масс: д ля одностадийной реакции при постоянной температуре скорость прямопропорциональна произведению концентраций реагирующих веществ.
Катализ – изменение скорости реакции под действием катализатора.
Катализатор - вещество, изменяющие скорость химической реакции, но остающееся в результате реакции химически неизмененными и в неизменном количестве.
Константа скорости химической реакции – скорость химической реакции при единичных концентрациях реагирующих веществ.
Константа химического равновесия – отношение констант скоростей прямой и обратной реакции.
Порядок реакции – с умма показателей степеней при концентрациях реагентов в кинетическом уравнении реакции.
Правило Вант-Гоффа: п ри повышении температуры на каждые 10 градусов скорость гомогенной реакции возрастает в 2-4 раза.
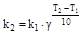
Принцип Ле Шателье: если на систему, находящуюся в состоянии динамического равновесия, оказано внешнее воздействие, то равновесие смещается в сторону процесса, ослабляющего оказанное воздействие.
Скорость химической реакции - это число актов химического взаимодействия за единицу времени в единице реакционного пространства.
Уравнение Аррениуса: 
Энергия активации – м инимальное количество энергии, которое необходимо сообщить системе, чтобы взаимодействие стало возможным.
Энтропия активации – функция, отражающая вероятность надлежащей ориентации взаимодействующих молекул. Изменение этой характеристики в процессе реакции определяется следующим соотношением:
 ,
,
где W1 - число возможных ориентаций молекул, W2 - число благоприятных ориентаций.
Поиск по сайту: