 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекция 12. Метод молекулярных орбиталей
Метод молекулярных орбиталей (ММО), являющийся в настоящее время наиболее широко используемым приемом описания химической связи, базируется на иных представлениях, нежели метод валентных связей. Если метод валентных связей стремится выделить в молекуле отдельные пары атомов, между которыми возникают двухцентровые локализованные связи, то метод молекулярных орбиталей рассматривает молекулу как единую частицу, электроны которой заселяют молекулярные орбитали, принадлежащие молекуле как целому. В результате описание молекулы по методу молекулярных орбиталей имеет много общего с описанием многоэлектронного атома. Чтобы описать молекулу по методу МО, необходимо сконструировать набор молекулярных орбиталей, построить энергетическую диаграмму, расположив полученные орбитали в порядке возрастания их энергий, а затем распределить на них электроны молекулы. Метод МО более универсален и прост по сравнению с методом ВС, но уступает последнему в наглядности. Свое развитие ММО получил в трудах Р. Малликена, Ф. Хунда и ряда других исследователей.
Существует несколько вариантов ММО, отличающихся принципами конструирования молекулярных орбиталей; наиболее популярным из них является метод МО ЛКАО (аббревиатура тезиса: "Молекулярная орбиталь - линейная комбинация атомных орбиталей"), в случае которого волновая функция молекулы YМО конструируется по уравнению
YМО = SсijI
где ji - атомные орбитали входящих в молекулу атомов, сi - коэффициенты, определяющие "долю" участия данной атомной орбитали в сформированной МО. Набор атомных орбиталей, используемых для построения молекулярных орбиталей, называется атомным базисом. В основе метода МО ЛКАО лежат следующие положения:
1. Состояние каждого электрона в многоатомной молекуле описывается молекулярной волновой функцией YМО, квадрат которой в любой точке пространства пропорционален вероятности нахождения электрона в объеме dV, включающем данную точку.
2. Число молекулярных орбиталей равно числу атомных орбиталей, образующих атомный базис.
3. Каждой МО соответствует определенный энергетический уровень; заполнение орбиталей электронами начинается с самого нижнего уровня (как в многоэлектронном атоме).
4. Молекулярные орбитали подчиняются принципу Паули и правилу Хунда: на каждой МО могут находиться два электрона с антипараллельными спинами; при наличии нескольких вырожденных МО электронные пары на них начинают формироваться лишь после того, как все эти орбитали заполнятся неспаренными электронами.
5. Не все орбитали атомного базиса можно комбинировать в молекулярные орбитали. Комбинируемые орбитали должны перекрываться (перекрывание может быть как положительным, так и отрицательным), быть близкими по энергии и обладать сходной симметрией относительно оси связи. Если хотя бы одно из этих условий не выполняется, соответствующие атомные орбитали переходят в молекулу без изменения.
Различают три типа молекулярных орбиталей: связывающие, разрыхляющие (антисвязывающие) и несвязывающие. Связывающие МО имеют энергию, меньшую по сравнению с исходными атомными орбиталями. Их заполнение стабилизирует молекулу. Разрыхляющие молекулярные орбитали имеют энергию более высокую по отношению к исходным АО. Заполнение электронами разрыхляющих МО ведет к дестабилизации частицы. Несвязывающие МО локализованы на отдельных атомах и фактически представляют собой атомные орбитали, перенесенные в молекулу без изменения. По симметрии МО разделяют на s (симметричные относительно линии связи) и p (антисимметричные относительно линии связи). Последние меняют знак волновой функции при повороте вокруг линии связи.
Рассмотрим электронное строение двухатомных молекул, образованных элементами первого периода. В качестве базисного набора АО будем использовать 1s-орбитали, линейные комбинации волновых функций которых дадут y-функции двух молекулярных орбиталей:
y1 = с1j1sA + c2j1sB; y2 = с3j1sA - c4j1sB
Форма граничной поверхности полученных МО и энергетическая диаграмма молекулы имеют следующий вид:
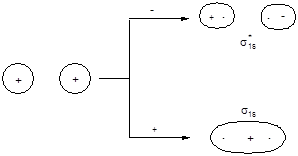
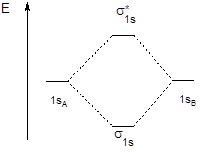
АО МО
Разместив на МО электроны, получим электронные формулы соответствующих молекулярных частиц.
Метод МО не требует использования понятия валентность. В то же время важное значение для описания молекул имеет характеристика, называемая кратностью связи. Кратность (порядок) связи определяют как полуразность числа электронов на связывающих и разрыхляющих орбиталях:
КС = 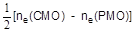
Кратность связи может быть как целочисленной, так и дробной величиной.
Метод молекулярных орбиталей позволяет оценить ряд важнейших характеристик молекул. К ним относятся:
1. Принципиальная возможность существования частиц. Частица может существовать, если кратность связи для нее больше нуля. При кратности связи, равной нулю, частица неустойчива.
2. Энергия связи. Энергия связи тем выше, чем больше кратность связи. При одинаковых значениях кратности связи энергия связи для различных частиц могут отличаться в зависимости от природы последних.
3. Длина связи (межъядерное расстояние). Межъядерное расстояние тем меньше, чем больше кратность связи.
4. Магнитные свойства частиц. По своему отношению к внешнему магнитному полю частицы делятся на две группы:
а) парамагнитные частицы, втягиваемые магнитным полем; такие частицы содержат неспаренные электроны;
б) диамагнитные частицы, выталкиваемые магнитным полем; все электроны таких частиц спарены.
Метод МО позволяет установить, содержит ли частица неспаренные электроны и, следовательно, является ли она парамагнитной или диамагнитной.
Таблица 17.
Электронные формулы и некоторые свойства двухатомных гомоядерных молекул, образованных
элементами первого периода
| Частица | Электронная формула | КС | Магнитное поведение |
| H2+ | (s1s)1 | 1/2 | Парамагнетик |
| H2 | (s1s)2 | Диамагнетик | |
| H2- | (s1s)2(s1s*)1 | 1/2 | Парамагнетик |
| He2+ | (s1s)2(s1s*)1 | 1/2 | Парамагнетик |
| He2 | (s1s)2(s1s*)2 | - |
При конструировании МО двухатомных гомоядерных молекул, образованных элементами второго периода, в качестве исходных АО можно использовать 2s- и 2p-орбитали. 1s-Орбитали входят в состав молекулы без изменения, т.е. являются несвязывающими. Схема и результат взаимодействия волновых функций 2s-орбиталей аналогичны рассмотренным выше для s-орбиталей элементов первого периода. 2px-Орбитали, ориентированные по линии связи, взаимодействуют с образованием двух s-МО:
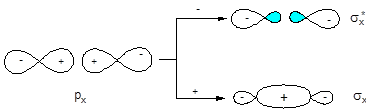
АО МО
Взаимодействие 2p-орбиталей, ориентированных по осям y и z, приводит к образованию двух эквивалентных наборов p-МО (pz, pу):

АО МО
Энергетическая диаграмма молекулярных орбиталей двухатомной молекулы, образованной элементами конца второго периода (начиная с кислорода), имеет вид, представленный на схеме справа.
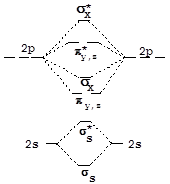

У элементов, расположенных в начале второго периода, близость энергии 2p- и 2s-орбиталей приводит к участию последних в формировании sх-орбиталей и увеличению их энергии. Вследствие этого на энергетической диаграмме уровни sх и py,z меняются местами (левая часть рисунка). Разместив электроны на МО в порядке возрастания их энергии, получим электронные формулы соответствующих молекулярных частиц.
Таблица 18.
Электронные формулы и некоторые свойства двухатомных гомоядерных молекул, образованных
элементами второго периода
| Частица | Электронная формула | КС | Магнитное поведение | |||||
| Li2 | KK(ss)2 | Д | ||||||
| Be2 | KK(ss)2(ss*)2 | - | ||||||
| B2 | KK(ss)2(ss*)2(py)1(pz)1 | П | ||||||
| C2 | KK(ss)2(ss*)2(py)2(pz)2 | Д | ||||||
| N2 | KK(ss)2(ss*)2(py)2(pz)2(sx)2 | Д | ||||||
| O2+ | KK(ss)2(ss*)2(sx)2(py)2(pz)2(py*)1 | 2,5 | П | |||||
| O2 | KK(ss)2(ss*)2(sx)2(py)2(pz)2(py*)1(pz*)1 | П | ||||||
| O2- | KK(ss)2(ss*)2(sx)2(py)2(pz)2(py*)2(pz*)1 | 1,5 | П | |||||
| F2 | KK(ss)2(ss*)2(sx)2(py)2(pz)2(py*)2(pz*)2 | Д | ||||||
| Ne2 | KK(ss)2(ss*)2(sx)2(py)2(pz)2(py*)2(pz*)2(sx*)2 | - | ||||||
Из полученных данных видно, что метод МО более адекватно отражает физические свойства молекул, в частности, он объясняет парамагнетизм молекулы кислорода. Кроме этого метод молекулярных орбиталей позволяет описать как одноэлектронные, так и делокализованные связи. Однако он несколько проигрывает методу валентных схем в наглядности.
Двухатомные гетероядерные молекулы
Двухатомные гетероядерные молекулы типа АВ можно подразделить на две группы, отнеся к первой из них частицы, построенные из атомов элементов одного периода, а ко второй - из атомов элементов разных периодов.
Если элементы А и В принадлежат одному периоду, то для описания частиц АВ можно использовать набор молекулярных орбиталей, построенных для гомоядерных частиц А2. Однако в этом случае вклады атомов А и В в связывающие и разрыхляющие орбитали не будут одинаковы: атом, имеющий большую электроотрицательность, вносит больший вклад в связывающие МО, атомом с меньшей электроотрицательностью - в разрыхляющие МО. В результате коэффициенты с1, с2, с3 и с4 в уравнениях (5-13) и (5-14) не могут быть равны. Если cА < cВ, то с2 будет больше с1, а с3 будет больше с4. Соответственно граничные поверхности молекулярных орбиталей перестанут быть симметричными: электронная плотность, отвечающая "связывающим" электронам будет смещена к атому с большей электроотрицательностью, тогда как вероятность нахождения "разрыхляющих" электронов будет выше вблизи атома с меньшей электроотрицательностью. В качестве примера на рис. 22 приведены граничные поверхности sz-орбиталей для подобных молекул.
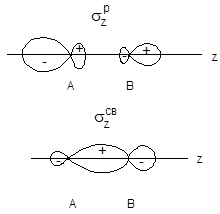
Рис. 22. szсв- и szр-орбитали молекулы АВ (cА<cВ)
Применение метода МО к молекулам типа АВ позволяет объяснить некоторые свойства последних, не находящие объяснения в рамках метода ВС. Так, например, в молекуле оксида углерода(II), согласно методу ВС, имеет место образования тройной связи, причем одна из p-связей образуется по донорно-акцепторному механизму за счет неподеленной электронной пары кислорода.
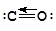
Можно ожидать, что молекула СО будет полярной с отрицательным зарядом на углероде. В действительности же полярность данной молекулы очень мала и составляет 0,4×10-30 Кл×м. Метод МО объясняет данное явление достаточно убедительно. Молекула СО изоэлектронна молекуле N2 и отвечает электронной формуле (ssсв)2 (ssp)2(px,yсв)4(szсв)2, соответственно которой 8 из 10 валентных электронов находятся на связывающих орбиталях. Поскольку электроотрицательность кислорода больше электроотрицательности углерода, электроны связывающих орбиталей преимущественно находятся возле атома кислорода, в результате чего перетекание электронной плотности от кислороду к углероду не наблюдается.
Поиск по сайту: