 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Катализаторы и катализ
|
Читайте также: |
Важнейшими факторами, влияющими на скорость химической реакции, являются концентрация реагентов, температура, энергия активации, энтропия активации и катализаторы. Остановимся на характеристике каждого из этих факторов.
1. Влияние концентрации.
Химические реакции можно подразделить на реакции соударения, требующие для своего осуществления столкновения двух или нескольких частиц, и реакции возбуждения, в случае которых молекула поглощает энергию, переходит в возбужденное состояние, а затем разрушается, образуя продукты реакции. Для обеих групп реакций повышение концентрации реагирующих веществ вызовет увеличение скорости реакции в результате увеличения абсолютного числа результативных столкновений или актов перехода молекул в возбужденное состояние, хотя отношение результативных столкновений к общему числу столкновений, как и доля активированных молекул от их общего числа, не изменится. Количественно зависимости скорости реакции от концентрации определяется законом действующих масс (К. Гульдберг, П. Вааге, 1879 г.): д ля одностадийных реакций при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Так, для одностадийной реакции
аА + bB = AaBb
скорость реакции
v = k.CA.CA...CA.CB.CB...CB
(а раз) (b раз)
или
v = k  ,
,
где С - концентрации реагентов, k - коэффициент пропорциональности, который не зависит от концентрации и называется константой скорости реакции. Константа скорости зависит от природы реагирующих веществ и от температуры; она численно равна скорости реакции при концентрациях реагентов, равных единице. Например, для одностадийной реакции
2NO + Cl2 = 2NOCl
v = k 
Если реакция многостадийна, то закон действующих масс можно применить к каждой стадии процесса. При этом определяющее влияние на процесс будет иметь скорость самой медленной стадии. Отсюда следует, что стехиометрические коэффициенты уравнения реакции нельзя переносить в кинетическое уравнение скорости, если нет уверенности в том, что эта реакция протекает в одну стадию.
Если реакция гетерогенна, то скорость ее будет зависеть от площади поверхности соприкосновения веществ, участвующих во взаимодействии. Так, для реакции
mA(г) + nB(к) = AmBn(к)
скорость реакции
 ,
,
где SB - поверхность вещества В, соприкасающаяся с газом А. Если SB допустимо считать величиной постоянной, то уравнение закона действующих масс (ЗДМ) примет следующий вид:
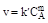
Для реакций между газообразными веществами концентрации в уравнении ЗДМ могут быть заменены парциальными давлениями соответствующих газов, так как в соответствии с уравнением состояния идеального газа давление и концентрация взаимосвязаны

Так, для реакции
С(графит) + СО2(г) = 2СО(г),
которую можно рассматривать как одностадийную,
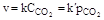
2. Влияние температуры.
C повышением температуры возрастает кинетическая энергия молекул. В результате увеличивается доля частиц, преодолевших энергетический барьер, определяемый энергией активации. Отсюда следует, что с повышением температуры скорость реакции должна возрастать. Влияние температуры на скорость реакции позволяет приближенно оценить эмпирическое правило Вант-Гоффа (1884 г.): п ри повышении температуры на каждые 10 ˚С скорость гомогенной реакции возрастает в одно и то же число раз.
В соответствии с этим правилом
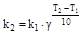
где k1 и k2 - константы скорости реакции при температурах Т1 и Т2, γ - температурный коэффициент скорости реакции, зависящий от природы реагирующих веществ и принимающий для большинства реакций значения от двух до четырех.
Более строго температурная зависимость скорости реакции передается уравнением С. Аррениуса, согласно которому

где А - предэкспоненциальный множитель, физический смысл которого будет объяснен ниже, е - основание натурального логарифма, Еа - энергия активации процесса.
3. Влияние энергии активации.
С увеличением энергии активации уменьшается доля частиц, преодолевающих энергетический барьер, что влечет за собой уменьшение скорости реакции. Поскольку температура слабо влияет на энергию активации, при расчетах ее величину можно считать постоянной для данной реакции. Влияние энергии активации на скорость реакции весьма существенно. Так, при стандартных условиях понижение энергии активации на 20 кДж влечет за собой увеличение константы скорости в 3000 раз, а на 100 кДж в 3×1017 раз.
4. Влияние энтропии активации.
Необходимым условием осуществления химического акта для реакций столкновения является надлежащая ориентация молекул в момент столкновения, позволяющая образоваться активированному комплексу. Так, если для реакции
А2 + В2 = 2АВ
активированный комплекс имеет форму, представленную на рис. 39,а, столкновение, показанное на рис. 39,б будет благоприятствовать протеканию реакции, а на рис. 58,в - нет.

Рис. 39. Благоприятное (б) и неблагоприятное (в) столкновение при образовании
активированного комплекса (a)
Вероятность надлежащей ориентации взаимодействующих молекул характеризует энтропия активации Sa. Изменение этой характеристики в процессе реакции определяется следующим соотношением:

где W1 - число возможных ориентаций молекул, W2 - число ориентаций, благоприятствующих взаимодействию. Величина ΔSa входит в предэкспоненциальный множитель уравнения Аррениуса:

где Z - множитель, пропорциональный частоте столкновений взаимодействующих частиц при концентрациях, равных 1 моль/л. Для реакций столкновения W2 < W1 и ΔSa < 0. Для реакций возбуждения W2 = W1 и Δ Sa = 0. С учетом энтропии активации уравнение Аррениуса принимает следующий вид:
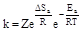
5. Влияние катализатора.
Катализаторами называют вещества, изменяющие скорость химической реакции, но остающиеся в результате реакции химически неизмененными и в том же количестве.
Изменение скорости реакции в присутствии катализатора называется катализом.
Катализаторы могут как ускорять, так и замедлять химические процессы. Катализаторы, увеличивающие скорость реакции, называются положительными, а катализаторы, уменьшающие скорость реакции - отрицательными или ингибиторами. Так, например, для реакции
2Н2О2 = 2Н2О + О2
положительным катализатором является диоксид марганца MnO2, а отрицательным - пирофосфат натрия Na4P2O7. Иногда катализатором является один из продуктов реакции. Такое явление называется автокатализом. Например, реакция окисления щавелевой кислоты перманганатом калия по уравнению:
2MnO  +5H2C2O4 + 6H+ = 2Mn2+ + 10CO2 + 8Н2О
+5H2C2O4 + 6H+ = 2Mn2+ + 10CO2 + 8Н2О
непосредственно после смешивания растворов реагентов протекает весьма медленно, однако постепенно скорость процесса возрастает, достигает максимума, а затем начинает понижаться. Это явление, противоречащее, казалось бы, закону действующих масс, связано с тем, что реакцию катализируют ионы Mn2+, концентрация которых по мере протекания реакции возрастает.
По фазовому состоянию различают гомогенные и гетерогенные катализаторы. Гомогенный катализатор находится в одной фазе с реагирующими веществами; катализ в этом случае называют гомогенным катализом. Гетерогенный катализатор образует самостоятельную фазу. Изменение скорости реакции под действием гетерогенного катализатора, называется гетерогенным катализом; в этом случае процесс протекает на поверхности раздела фаз. Так, для реакции разложения пероксида водорода Na4P2O7 является гомогенным катализатором, а MnO2 - гетерогенным.
Механизм действия катализаторов (как гомогенных, так и гетерогенных) сводится к тому, что катализатор изменяет энергию активации процесса, понижая ее при положительном катализе и повышая при отрицательном.
Механизм гомогенного катализа объясняет теория промежуточных соединений, согласно которой катализатор вступает во взаимодействие с одним или несколькими реагентами, образуя интермедиаты, которые затем вступают в реакцию, сопровождающуюся освобождением катализатора.
Пусть реакция
А + В = А×××В = АВ
характеризуется высокой энергией активации (Еа) и протекает медленно. В присутствии катализатора К эта реакция осуществляется в две стадии
А + К =А×××К = АК
АК + В = А×××К×××В = АВ + К
с энергиями активации Eа΄ и Еа˝. Если энергия активации каждой стадии меньше Еа, скорость реакции возрастет, и в системе будет иметь место положительный катализ. Путь такой реакции показан на рис. 40. Еcли окажется, что Eа΄ < Еа, но Еа˝ > Еа, то катализатор поведет реакцию по пути с большей энергией активации и скорость реакции уменьшится (отрицательный катализ или ингибирование).

Рис. 40. Механизм гомогенного катализа
Механизм действия гетерогенного катализатора более сложен и включает стадию адсорбции одного из веществ (субстрата) на активных центрах поверхности раздела фаз. При этом он определенным образом ориентируется по отношению к матрице катализатора. После взаимодействия реагентов образуется новое вещество, вследствие чего нарушается принцип геометрического соответствия субстрата и активного центра катализатора. Продукт реакции десорбируется, освобождая место для новой молекулы.
Механизм действия гетерогенного катализатора реакции гидрирования этилена можно представить следующей схемой:
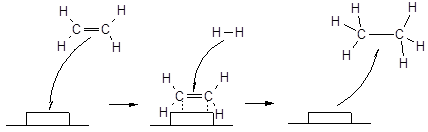
Рис. 41. Механизм гетерогенного катализа
Вещества, усиливающие действие катализатора, называются промоторами (активаторами). Так, небольшая добавка сульфатов щелочных металлов значительно повышает активность V2O5, катализирующего окисление оксида серы(IV). В то же время незначительные примеси некоторых веществ могут снижать или полностью подавлять активность катализатора. Такие вещества называют каталитическими ядами.
Биохимические процессы немыслимы без ферментативного катализа. Ферменты (энзимы) - это катализаторы биохимических реакций. Они имеют белковую природу, содержат активные центры, включающие зачастую катион металла, и характеризуются следующими признаками:
ü высочайшей эффективностью (ускоряют реакции в миллионы раз);
ü стереоселективностью (субстрат со строго определенной геометрией молекулы укладывается в нишу с активным центром фермента по принципу ”ключ - замок”);
ü субстратной избирательностью - фермент обслуживает строго определенные классы соединений и типы реакций.
Поиск по сайту: