 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Механизмы образования двухцентровой связи. Насыщаемость ковалентной связи
Двухцентровая связь может образовываться двумя путями, соответственно чему различают два механизма образования ковалентной связи.
1. Обменный механизм. Связующие электронные пары формируются из непарных электронов взаимодействующих атомов по схеме:

По обменному механизму образуется, например, связь в молекуле водорода, полученного при взаимодействии цинка с хлороводородной кислотой:
Zn + 2HCl = ZnCl2 + 2H·

2. Донорно-акцепторный механизм. Двухэлектронная связь образуется за счет свободной (вакантной) орбитали одного из атомов и неподеленной электронной пары другого атома по схеме:

При этом атом, предоставляющий для образования связи электронную пару, называется донором, а атом, предоставляющий вакантную орбиталь, - акцептором. Донорно-акцепторный механизм реализуется, в частности, в молекулах водорода, образующихся при взаимодействии хлороводородной кислоты с гидридом натрия по уравнению
HCl + NaH = NaCl + H2

В данном случае катион водорода является акцептором, а гидрид-анион - донором.
Заметим, что связи, образованные по обменному и донорно-акцепторному механизмам, отличаются лишь по происхождению электронной пары, обеспечивающей связь. По остальным характеристикам (длина связи, энергия связи, валентные углы) эти связи абсолютно идентичны. Так, в ионе NH4+ три связи N-H образованы по обменному механизму, а одна - по донорно-акцепторному, однако установить, какой из атомов водорода выступает в качестве акцептора невозможно, так как все связи в ионе аммония идентичны.
При записи химических формул, связь образованную по донорно-акцепторному механизму, иногда обозначают не черточкой, а стрелкой, направленной от донора к акцептору.
Сущность насыщаемости ковалентной связи состоит в том, что атом любого элемента может образовать лишь конечное число двухцентровых связей.
Насыщаемость связи обусловлена принципом Паули, справедливым как для изолированных атомов, так и для атомов, входящих в молекулу. Количество электронов, осуществляющих ковалентную связь, не может превысить емкость энергетических подуровней, которые "задействованы" при образовании связей данным атомом. Так, например, для атома углерода (электронная конфигурация 1s22s22p2) валентными являются 2s- и 2р-подуровни; максимальное число электронов на этих уровнях равно восьми. Соответственно атом углерода не может образовывать более четырех двухцентровых связей за счет четырех электронных пар. Насыщаемость связи обеспечивает определенный состав и структуру молекулярных соединений.
Представление о насыщаемости связи позволяет достаточно строго сформулировать определение валентности в соединениях с локализованными ковалентными связями. Валентность в соединениях с локализованными связями (ковалентность) - это мера способности атома к образованию связи, количественным выражением которой является число двухэлектронных связей, образуемых атомом за счет непарных электронов, неподеленных электронных пар и вакантных орбиталей, т.е. по обменному и донорно-акцепторному механизмам.
В соответствии с этим определением нетрудно оценить валентные возможности и теоретически возможную максимальную валентность атома того или иного элемента. Сразу же отметим, что максимальные валентности не всегда реализуются в действительности.
Рассмотрим вопрос о валентных возможностях элементов на примере элементов второго периода, для которых валентными являются 2s- и 2р-орбитали (рис. 13).
Открывающий второй период литий, атом которого имеет один валентный электрон, может образовывать одну связь по обменному механизму, проявляя валентность, равную единице. В то же время наличие у атома лития трех вакантных орбиталей позволяет ему образовывать еще три связи по донорно-акцепторному механизму, в результате чего максимальная валентность лития равна четырем. Правда, соединения четырехвалентного лития весьма немногочисленны. Подобное соединение, например, образуется при взаимодействии гидроксида лития с салициловым альдегидом:
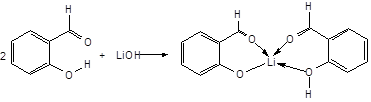
В этой реакции в качестве доноров выступают атомы кислорода, имеющие неподеленные электронные пары.
Атом бериллия не имеет неспаренных электронов в невозбужденном состоянии и, соответственно, в таком состоянии не образует связи по обменному механизму. В то же время, формально он способен образовать четыре связи по донорно-акцепторному механизму (одну как донор и три как акцептор), но реально такая схема взаимодействия для бериллия не зарегистрирована. Однако атом бериллия легко переходит в возбужденное состояние (необходимая для этого энергия составляет 259 кДж/моль), в котором проявляет максимальную валентность, равную четырем, так как способен образовывать две связи по обменному механизму и две по дононорно-акцепторному, выступая в качестве акцептора. Примером частицы, в которой бериллий реализует максимальную валентность, может служить ион [BeF4]2-.
| Элемент | Распределение электронов | Максимальная валентность | Примеры соединений | |||
| По обменному механизму | По донорно-акцеп-торному механизму | Общая | ||||
| До-нор | Ак-цептор | |||||
| Li | 
| - 3 | LLiLH *) | |||
| Be | 
| - 2 | [BeF4]2- | |||
| B | 
| - 1 | [BF4]1- | |||
| C | 
| - - | CF4 | |||
| N | 
| 1 - | [NH4]1+ | |||
| O | 
| 2 - | Be4O(Ac)6 *) | |||
| F | 
| 3 - | Нет | |||
| Ne | 2s22p6 | - | 4 - | Нет | ||
*) (LH - C6H4(OH)CHO, Ac - CH3COO-
Рис. 13. Распределение электронов на валентных подуровнях и максимальные значения валентности для элементов второго периода
Валентные возможности остальных элементов второго периода, реализуемые различными путями, показаны на рис. 13. Как следует из рисунка, для всех элементов рассматриваемого периода максимальное значение валентности равно четырем. Однако эта валентность реализуется не у всех элементов. Уже кислород проявляет валентность четыре крайне редко; примером таких соединений является основной ацетат бериллия Be4O(CH3COO)6, имеющий следующее строение:
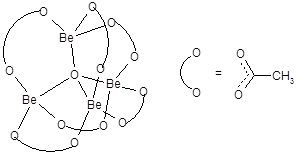
Центральный атом кислорода образует в этом соединении четыре связи с атомами бериллия.
Соединения четырехвалентного фтора и тем более четырехвалентного неона не получены.
Все рассмотренные выше элементы могут проявлять валентность меньше максимальной. Так, бериллий в газообразном фториде бериллия BeF2 двухвалентен; в образовании связей в этом случае принимают участие лишь две из четырех валентных орбиталей бериллия.
В заключение, обобщая сказанное выше, сформулируем несколько общих правил, характеризующих валентность как свойство элемента.
1. Валентность элемента в ковалентных соединениях равна числу электронных орбиталей его атома, участвующих в образовании химических связей по обменному и донорно-акцепторному механизмам.
2. Максимальное значение валентности элемента не может превысить число орбиталей валентных подуровней его атома.
3. Максимальная теоретически возможная валентность элемента определяется номером периода, но не зависит от номера группы, в которой находится элемент.
Направленность ковалентной связи. Гибридизация электронных орбиталей
Ковалентная связь тем прочнее, чем сильнее перекрываются атомные орбитали взаимодействующих атомов. Действительно, чем полнее перекрывание атомных орбиталей, тем выше электронная плотность между ядрами, ниже энергия образовавшейся частицы и, следовательно, выше энергия связи. Поскольку атомные орбитали ориентированы в пространстве строго определенным образом, для максимального перекрывания электронных орбиталей необходимо, чтобы взаимодействующие атомы были определенным образом ориентированы друг относительно друга. В результате образующиеся молекулы должны иметь определенную геометрическую форму, обеспечивающую максимальное перекрывание и наиболее прочную связь.
В качестве примера рассмотрим строение молекулы теллуроводорода. Теллур, аналог кислорода, имеет электронную конфигурацию 5s25p4. Образование связей в молекуле Н2Те происходит за счет перекрывания 1s-орбиталей двух атомов водорода с двумя 5р-орбиталями атома теллура (например, 5px и 5pz). Поскольку 5px-орбиталь направлена по оси х, а 5pz-орбиталь - по оси z, максимальное перекрывание будет наблюдаться тогда, когда ядро одного атома водорода окажется на оси х, а другого - на оси z (рис. 14,а). Вследствие этого молекула теллуроводорода должна иметь угловую форму с углом между связями Те-Н, близким к 90 °, т.е. углу между орбитали px и pz. Экспериментально определенное значение валентного угла в молекуле Н2Те составляет 90,25 °. Аналогично молекула гидрида сурьмы SbH3, в которой связи образуются в результате перекрывания трех 5р-орбиталей сурьмы с 1s-орбиталями трех атомов водорода, должна иметь форму тригональной пирамиды с прямыми углами при вершине. Действительно, валентные углы для молекулы SbH3 составляют 91,6 °, т.е. весьма близки к ожидаемым (рис. 14,б).

Рис. 14. Перекрывание атомных орбиталей при образовании молекул TeH2(a) и SbH3(б)
Более сложная картина наблюдается в том случае, когда атом предоставляет для образования связей орбитали различных подуровней. Рассмотрим это вопрос на примере молекул газообразного фторида бериллия. Атом бериллия в этом соединении образует две связи с атомами фтора по обменному механизму, что требует перехода электронной конфигурации невозбужденного атома 2s2 в конфигурацию 2s12p1. В результате можно ожидать, что связи в молекуле ВеF2 не будут равноценными, так как одна из них образуется за счет s-электрона, а вторая - за счет р-электрона. Однако в действительности обе связи в молекуле BeF2 абсолютно равноценны как по длине, так и по энергии. Аналогичное явление наблюдается для молекул BF3 и CF4, все связи в которых идентичны. Для объяснения этих и множества других подобных фактов Л. Полингом была предложена теория гибридизации электронных орбиталей.
Л. Полинг показал, что понижение энергии системы при образовании молекул становится более значительным, если волновые функции орбиталей, используемых атомом для образования связей, заменить их линейной комбинацией. Подобное "смешивание" волновых функций атома называется гибридизацией электронных орбиталей, а полученные в результате этой операции "смешанные" волновые функции - гибридными орбиталями. В результате гибридизации из нескольких отличающихся по энергии, форме граничной поверхности и кривой распределения электронной плотности орбиталей образуется такое же число одинаковых по энергии и форме граничной поверхности гибридных орбиталей. Последние ориентированы в пространстве таким образом, чтобы отталкивание между электронами было минимальным.
Рассмотрим простейший тип гибридизации, являющийся результатом смешивания s-орбитали и одной р-орбитали (например, рх) этот тип гибридизации называется sp-гибридизацией. Линейная комбинация взаимодействующих орбиталей Ys и Ypx выразится уравнением
Ysp = c1Ys + c2Ypx
где коэффициенты с1 и с2 определяют доли s- и р-характера полученной гибридной орбитали. Поскольку в данном случае s- и р-орбитали вносят в гибридную орбиталь одинаковые вклады, коэффициенты с1 и с2 равны по абсолютной величине, хотя могут отличаться по знаку, так как линейное комбинирование подразумевает как сложение, так и вычитание комбинируемых функций. Численные значения с1 и с2 можно найти, исходя из того, что гибридная функция должна быть нормированной (раздел 1.3). В этом случае

откуда

Поскольку s -и р-орбитали нормированы порознь, интегралы  и
и  равны единице. Интеграл
равны единице. Интеграл  является интегралом перекрывания s- и р-орбиталей, принадлежащих одному атому. Подобные орбитали обладают особым свойством, называемым ортогональностью: полное перекрывание любых двух орбиталей, принадлежащих одному атому, всегда является нулевым. Чтобы убедиться в этом достаточно взглянуть на рис. 15, на котором показано перекрывание s- и рх-орбиталей.
является интегралом перекрывания s- и р-орбиталей, принадлежащих одному атому. Подобные орбитали обладают особым свойством, называемым ортогональностью: полное перекрывание любых двух орбиталей, принадлежащих одному атому, всегда является нулевым. Чтобы убедиться в этом достаточно взглянуть на рис. 15, на котором показано перекрывание s- и рх-орбиталей.

Рис. 15. Построение sp-гибридных орбиталей
Области перекрывания s-орбитали каждым из лепестков рх-орбитали равны, однако для положительных значений х перекрывание положительно, а для отрицательных - отрицательно, в результате чего полное перекрывание равно нулю. Отсюда интеграл перекрывания  также равен нулю, соответственно
также равен нулю, соответственно

что приводит к двум уравнениям гибридных орбиталей


Изменение граничных поверхностей орбиталей при гибридизации показано на рис. 15. Как следует из рисунка, при нулевом полном перекрывании орбиталей (свойство ортогональности) перекрывание будет положительным в области положительных значений Yрх и отрицательным там, где Yрх < 0. В результате гибридные орбитали приобретают форму асимметричной гантели. Такая форма обеспечивает большее перекрывание при образовании связи, чем в случае "чистых" атомных орбиталей. Поэтому образование связей с участием гибридных орбиталей энергетически более выгодно.
Образовавшиеся гибридные орбитали ориентируются в пространстве так, чтобы силы отталкивания между находящимися на них электронами были минимальными. В случае sp-гибридизации гибридные орбитали ориентируются по одной оси в разные стороны, а угол между ними составляет 180 °.
Гибридные орбитали подчиняются всем квантово-механическим законам: на гибридной орбитали могут находиться не более двух электронов с антипараллельными спинами (принцип Паули), на вырожденных гибридных орбиталях электроны распределяются так, чтобы суммарный спин их был максимальным (правило Хунда).
Не все атомные орбитали могут быть гибридизованы. Устойчивая гибридизация требует соблюдения определенных условий:
1. Гибридизируемые орбитали должны быть близки по энергии. По этой причине s- и р-орбитали гибридизируются лишь тогда, когда они принадлежат одному и тому же энергетическому уровню. В случае d-орбиталей дело обстоит несколько иначе. Поскольку (n-1)d-орбитали не слишком сильно отличаются по энергии от ns-орбиталей, возможны два варианта гибридизации:
а) Внешняя гибридизация, при которой гибридизируются s-, p- и d-орбитали, принадлежащие одному энергетическому уровню и характеризующиеся одинаковым значением главного квантового числа. В случае этого типа гибридизации d-орбитали записываются после p-орбиталей (например, sp3d2);
б) Внутренняя гибридизация - гибридизируются (n-1)d-, ns- и np-орбитали. При записи данного типа гибридизации d-орбитали предшествуют s-орбиталям (например, d2sp3);
2. Гибридизируемые орбитали должны иметь достаточно высокую электронную плотность. В подгруппах периодической системы с увеличением главного квантового числа размеры орбиталей увеличиваются, а число электронов на валентных орбиталях не изменяется, в результате чего электронная плотность понижается. Поэтому в подгруппах элементов при перемещении сверху вниз способность к гибридизации атомных орбиталей убывает. Именно по этой причине в рассмотренных выше молекулах TeH2 и SbH3 связи образуются за счет p-орбиталей, а гибридизация не наблюдается.
Случай sp-гибридизации был рассмотрен выше. Этот тип гибридизации сопровождается образованием из s- и одной р-орбитали двух гибридных орбиталей и обеспечивает валентный угол, равный 180 °. sp-Гибридизации соответствует образование линейных молекул, примером которых может служить молекула газообразного гидрида бериллия (рис. 16,а).
В случае sp2-гибридизации смешиваются s- и две р-орбитали. Полученные при этом асимметричные гибридные орбитали лежат в одной плоскости, образуя равносторонний треугольник; угол между смежными орбиталями составляет 120°. sp2-Гибридизации подвергается, например, атом бора в молекуле ВН3, имеющей форму равностороннего треугольника (рис. 11,б). Следует отметить, что молекула ВН3 нестабильна и существует лишь в газовой фазе при высокой температуре, а при обычных температурах она димеризуется в диборан В2Н6.
При sp3-гибридизации из s- и трех р-орбиталей образуется четыре гибрида, направленные от центра тетраэдра к его вершинам. Валентный угол в молекулах с sp3-гибридизацией центрального атома составляет 109,5 °; примером молекул с данным типом гибридизации может служить молекула метана (рис. 16,в).

Рис. 16. Строение молекул BeH2(а), BH3(б) и CH4(в)
Некоторые типы гибридизации с участием d-орбиталей представлены в табл. 14, в которой приведены геометрические модели гибридных орбиталей, значения валентных углов и примеры молекул и ионов, центральный атом которых подвергается данному типу гибридизации.
Таблица 4
Некоторые типы гибридизации с участием s-, p- и d-орбиталей
| Тип гибридизации | Геометрическая модель гибридных орбиталей | Валентные углы, ° | Примеры |
| sp | Прямая линия | BeF2 | |
| dp | Прямая линия | [Re2Cl8]2- | |
| sp2 | Треугольник | BF3 | |
| sp3 | Тетраэдр | 109,5 | [BF4]1- |
| d3s | Тетраэдр | 109,5 | [MnO4]1- |
| dsp2 | Квадрат | 90, | [AuCl4]1- |
| sp3d | Тригональная бипирамида | 90, 120, 180 | PCl5 |
| sp3d | Тетрагональная пирамида | 90, 180 | [Ni(CN)5]3- |
| sp3d2 | Октаэдр | 90, | SF6 |
Как правило, все орбитали, образующиеся при гибридизации данного типа, эквивалентны как по значениям валентных углов, так и по длине образующихся связей. Исключением является sp3d-гибридизация, в случае которой пять гибридных орбиталей образуют тригональную бипирамиду. При этом три орбитали располагаются в экваториальной плоскости (экваториальные орбитали), а две орбитали направлены перпендикулярно этой плоскости (аксиальные орбитали). Валентные углы, отвечающие этому типу гибридизации, не одинаковы (120° между экваториальными орбиталями, 180° между аксиальными орбиталями и 90° между экваториальными и аксиальными орбиталями). Связи, образованные за счет экваториальных и аксиальных орбиталей, несколько отличаются как по длине, так и по энергии. Так, в молекуле PСl5 длина связей P-Cl равна 202 пм для экваториальных и 212 пм для аксиальных орбиталей. Существует мнение, что dsp3-гибридизация не является индивидуальной, а представляет собой сочетание sp2-гибридизации (экваториальные орбитали) и pd-гибридизации (аксиальные орбитали). При таком подходе причины неэквивалентности гибридных орбиталей фосфора в PCl5 становятся очевидными.
На гибридных орбиталях могут находиться как неспаренные электроны, так и электронные пары, гибридные орбитали могут также оставаться вакантными. В результате подвергшийся гибридизации атом может образовывать связи как по обменному, так и по донорно-акцепторному механизму. Наличие в образовавшейся молекуле неподеленных пар на гибридных орбиталях оказывает влияние на геометрию частицы, искажая валентные углы, соответствующие данному типу гибридизации. Неподеленная пара электронов менее оттянута от ядра центрального атома, чем связывающая, находящаяся между ядрами. В связи с этим неподеленная электронная пара оказывает большее отталкивающее действие на другие электронные пары, нежели связывающая. В результате углы между орбиталями, занятыми связывающими парами, уменьшаются, а неподеленными - увеличиваются. В качестве примера рассмотрим строение молекул аммиака и воды (рис. 17). При образовании молекулы аммиака атом азота подвергается sp3-гибридизации; на четырех гибридных орбиталях распределяются пять электронов, что приводит к появлению неподеленной электронной пары; соответственно молекула аммиака имеет форму тригональной пирамиды (рис. 17,а). Валентный угол, отвечающий sp3-гибридизации, равен 109,5°, однако наличие неподеленной электронной пары приводит к его сжатию до 107,3°.
Образование молекул воды также сопровождается sp3-гибридизацией; две из четырех гибридных орбиталей заполняют неподленные пары, а остальные используются на образование связей О-Н по обменному механизму. В результате молекула воды имеет угловую форму, а валентный угол сжимается до 104,5°.

Рис. 17. Строение молекул NH3(а) и H2O(б)
Когда центральный атом в молекуле использует неподеленную пару для образования связи по донорно-акцепторному механизму, сжатие валентного угла исчезает, если неподеленная пара одна, или уменьшается, если неподеленных пар несколько. Так, присоединение аммиаком иона водорода приводит к образованию тетраэдрического иона NH4+, все валентные углы в котором равны 109,5°. Ион гидроксония, образующийся при присоединении иона водорода к молекуле воды, имеет форму тригональной пирамиды, для которой валентные углы НОН равны 109,0°.
При образовании молекул может наблюдаться и расширение валентных углов. Это явление имеет место тогда, когда на одной из гибридных орбиталей молекулярной частицы остается неспаренный электрон. Например, атом азота в молекуле NO2, подвергается sp2-гибридизации, две гибридные орбитали используются на образование связей с атомами кислорода, а на третьей сохраняется неспаренный электрон, который слабее отталкивает связывающие электронные пары, чем неподеленная пара. В результате валентный угол в молекуле диоксида азота составляет 131°, а не 120°.
Поиск по сайту: