 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекции 9-10. Основы теории химической связи. Метод валентных связей
Химическая связь - это взаимодействие ядер и электронов, приводящее к образованию устойчивой совокупности атомов - молекулярных частиц или атомных агрегатов. Движущей силой образования химической связи является стремление системы к минимуму энергии при достижении атомами завершенной электронной оболочки инертного газа (s2 или s2p6). В зависимости от способа приближения системы атомных частиц к устойчивому состоянию различают три типа химической связи: ковалентную, ионную и металлическую. В теории химической связи обычно рассматривают также силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса), являющиеся по своей сути физическим взаимодействием, и водородную связь, лежащую на границе физических и химических явлений.
Можно выделить две характерные черты, позволяющие отличить химическую связь от других видов межатомного взаимодействия:
1) образование многоатомной системы сопровождается понижением ее полной энергии сравнительно с суммой энергии атомов, образующих эту систему;
2) в процессе образования химической связи происходит перестройка электронных оболочек взаимодействующих атомов, сопровождающаяся перераспределением электронной плотности.
Важнейшими количественными характеристиками химической связи являются энергия связи, длина связи и валентный угол.
Энергия связи - это энергия, которую необходимо затратить на ее разрушение. Обычно энергию связи относят к молю связей и выражают в кДж/моль.
Если молекула состоит из двух атомов, энергия связи равна тепловому эффекту реакции распада молекулы на атомы. Так, атомизация хлороводорода протекает по уравнению
HCl ¾® H + Cl; DН = 427,8 кДж/моль
Соответственно и энергия связи ЕH-Cl составляет 427,8 кДж/моль.
В случае многоатомной молекулы, содержащей несколько одинаковых связей, средняя энергия связи будет равна тепловому эффекту реакции атомизации молекулы, деленному на число связей в молекуле. Например, средняя энергия связи О-Н в молекуле воды в соответствии с уравнением
Н2О ¾® 2Н + О; DН = 927 кДж/моль
составит
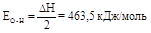
Следует подчеркнуть, что для многоатомной молекулы энергия связи является усредненной величиной и не равна энергии, затраченной на последовательный отрыв атомов от молекулы. Так, для отрыва атома водорода от молекулы воды требуется 499 кДж/моль, а от радикала ОН× - 428 кДж/моль. Среднее арифметическое от этих величин равно энергии связи О-Н. Для большинства соединений энергии связей являются величинами порядка 100-500 кДж/моль.
Длиной связи называется среднее расстояние между ядрами взаимодействующих атомов. Длина связи выражается обычно в нанометрах (1 нм = 1×10-9 м) или пикометрах (1 пм = 1×10-12 м) и для большинства связей составляет от 100 до 300 пм. Часто для измерения длины связей мспользуют внесистемную единицу – ангстрем (1 Å = 1×10-10 м или 100 пм).
Третьим параметром химической связи является валентный угол. Валентный угол - это угол, образуемый прямыми, проведенными через ядра центрального и присоединенных к нему атомов. Для большинства молекул значения валентных углов изменяются от 90° до 180°. Например, для молекул CH4, NH3 и H2O валентные углы составляют 109,5°, 107,3° и 104,5° соответственно. Валентные углы меньше 90° являются очень напряженными и реализуются редко.
С развитием квантово-механических представлений в теории химической связи сложились два метода описания ковалентной связи: метод валентных связей (метод ВС) и метод молекулярных орбиталей (метод МО).
Согласно методу ВС атомы, составляющие молекулу, сохраняют свою индивидуальность, а химические связи возникают в результате взаимодействия их валентных электронов и валентных орбиталей. Метод МО рассматривает молекулу как единое образование, в котором каждый электрон принадлежит молекулярной частице в целом и движется в поле всех ее ядер и электронов. Методы ВС и МО, несмотря на существенные различия в подходах к описанию молекул, хорошо дополняют друг друга. Во многих случаях они приводят в конечном итоге к одинаковым результатам.
Поиск по сайту: