 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Типы обменных реакций в растворах электролитов
Теория электролитической диссоциации показывает, что реакции в растворах электролитов фактически являются реакциями между ионами, на которые распадаются растворенные вещества. В связи с электростатическим взаимодействием разноименно заряженных частиц подобные реакции обычно характеризуются низкими энергиями активации и высокими скоростями. В большинстве своем ионные реакции обратимы, хотя зачастую очень сильно смещены в направлении образования продуктов реакции (практически необратимые процессы). Можно выделить две группы реакций в растворах электролитов: обменные реакции, протекающие без изменения степени окисления элементов, и окислительно-восстановительные реакции, сопровождающиеся изменением степени окисления элементов. В настоящем разделе рассмотрен вопрос об обменных реакциях в растворах электролитов.
В зависимости от того, какие продукты образуются в результате связывания ионов, можно выделить четыре группы реакций обмена в растворах.
1. Реакции, сопровождающиеся образованием растворимых слабых электролитов. Для процессов этого типа взаимодействие сводится к связыванию ионов в молекулы растворимого, но слабо диссоциирующего соединения (воды, слабых кислот и т.д.). Например, взаимодействие между ацетатом натрия и хлороводородной кислотой
CH3COONa + HCl = CH3COOH + NaCl
после учета диссоциации сильных электролитов (CH3COONa, HCl, NaCl) сводится к уравнению:
CH3COO- + H+ = CH3COOH
Образующимся слабым электролитом может быть также вода или слабо диссоциирующие соли. Так, реакциям
NaOH + HCl = NaCl + H2O
и
Hg(NO3)2 + 2KCl = HgCl2 + 2KNO3
соответствуют ионные уравнения
H+ + OH- = H2O
Hg2+ + 2Cl- = HgCl2
2. Реакции, сопровождающиеся образованием малорастворимых соединений (солей, оснований, кислот и др.). Ниже приведены примеры подобных реакций:
AgNO3 + NaCl = AgCl↓ + NaNO3
или
Ag+ + Cl- = AgCl↓
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
или
Cu2+ + 2OH- = Cu(OH)2↓
Na2WO4 + H2SO4 = H2WO4↓ + Na2SO4
или
WO 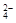 + 2H+ = H2WO4↓
+ 2H+ = H2WO4↓
3. Реакции, сопровождающиеся выделением газообразных продуктов. Примером подобных реакций может служить взаимодействие сульфида натрия с хлороводородной кислотой:
Na2S + 2HCl = 2NaCl + H2S↑
или
S2- + 2H+ = H2S↑
4. Реакции, сопровождающиеся образованием комплексных ионов. Ниже приведены примеры подобных реакций:
Hg(NO3)2 + 4KI = K2[HgI4] +2KNO3
или
Hg2+ + 4I- = [HgI4]2-
BeCl2 + 4NaF = Na2[BeF4] + 2NaCl
или
Be2+ + 4F- = [BeF4]2-
Обобщая сказанное, можно сформулировать следующее правило:
Реакции обмена в растворах электролитов протекают тогда, когда их продукты выводят ионы из зоны реакции в виде слабых электролитов, малорастворимых соединений, газов или комплексных ионов.
Сравнительно с молекулярными, ионные уравнения значительно информативнее, так как в них фигурируют частицы, реально участвующие во взаимодействии. Так, например, составление ионных уравнений позволяет ответить на вопрос, почему реакции
HCl + NaOH = NaCl + H2O,
HNO3 + KOH = KNO3 + H2O,
HClO4 +  Ba(OH)2 =
Ba(OH)2 =  Ba(ClO4)2 + Н2О
Ba(ClO4)2 + Н2О
имеют одинаковый тепловой эффект (-57,32 кДж/моль при ст. усл.), хотя во взаимодействие вступают разные кислоты и основания. Действительно, во всех рассмотренных случаях в системах протекает один и тот же процесс, описываемый ионным уравнением
H+ + OH- = H2O; ΔH˚ = -57,32 кДж/моль
Точно так же реакции
AgNO3 + HCl = AgCl↓ + HNO3,
AgClO4 + NaCl = AgCl↓ + NaNO3,
AgClO3 + NH4Cl = AgCl↓ + NH4ClO3
имеют одинаковый тепловой эффект, так как все они сводятся к одному ионному уравнению
Ag+ + Cl- = AgCl↓; ΔH˚ = -65,5 кДж/моль.
Лекции 27-28. Гидролиз солей. Буферные растворы
Одним из типов обменных реакций в растворах являются реакции гидролиза, т.е. реакции обменного взаимодействия вещества с водой. Гидролизу подвергаются различные классы неорганических и органических соединений: бинарные соединения ряда неметаллов, соли, сложные эфиры, углеводы и т.д. Примером реакции гидролиза может служить, например, гидролиз сульфида кремния
SiS2 + 4H2O = H4SiO4 + 2H2S
Реакции гидролиза следует отличать от реакций гидратации, при которых происходит присоединение воды частицами вещества. Так, например, реакция омыления уксусноэтилового эфира
СН3СООС2Н5 + Н2О  СН3СООН + С2Н5ОН
СН3СООН + С2Н5ОН
является реакцией гидролиза, а взаимодействие этилена с водой
С2Н4 + Н2О  С2Н5ОН
С2Н5ОН
- реакцией гидратации. В настоящем разделе рассмотрен вопрос о гидролизе солей в водных растворах.
Гидролизом соли называется обменное взаимодействие ионов соли с молекулами воды, сопровождающееся изменением концентрации ионов водорода и гидроксила в результате смещения равновесия диссоциации воды.
Гидролиз является следствием поляризационного взаимодействия ионов соли с молекулами воды, гидратирующими данный ион. Гидролизу могут подвергаться как катионы, так и анионы соли. Катионы гидратируются за счет присоединения молекул воды по донорно-акцепторному механизму и путем образования водородных связей между координированными и некоординированными молекулами воды. Пусть катион Xz+ присоединяет 4 молекулы воды, выступая акцептором электронных пар кислорода, а одна из координированных молекул воды образует водородную связь с внешнесферной молекулой воды (рис. 46,а). Катион Xz+ поляризует координированную молекулу Н-О′-Н′, причем индуцированный в молекуле воды диполь ориентирован отрицательным полюсом к иону Хz+, а положительным - к атомам водорода. В результате связь О'¾Н′ ослабевает и разрывается, а связь Н′∙∙∙О″ упрочняется и переходит в ковалентную. В растворе увеличивается концентрация отщепляемых ионов гидроксония. Гидролиз катиона, таким образом, протекает по уравнению
Xz+ + H2O  XOH(z-1)+ +H+
XOH(z-1)+ +H+
Катион гидратируется тем сильнее, чем больше его поляризующее действие, т.е. чем выше положительный заряд иона и меньше его радиус. Таким катионам соответствуют слабые основания.
Анионы в растворах гидратируются за счет образования водородных связей (рис. 46,б). Взаимодействие отрицательного заряда аниона с диполем молекулы воды приводит к усилению акцепторных свойств атома водорода Н′. В результате водородная связь Y∙∙∙Н′ переходит в ковалентную, а полярная связь О″- Н′ разрывается. Гидролиз протекает по уравнению
Yz- + H2O  HY(z-1)- + OH-
HY(z-1)- + OH-
а раствор приобретает щелочную реакцию. Анион гидролизуется тем сильнее, чем выше его отрицательный заряд и меньше радиус. Легко гидролизующимся анионам соответствуют слабые кислоты.


Рис. 46. Механизм гидролиза солей:
а) гидролиз катиона: б) гидролиз аниона
По характеру гидролиза соли можно разделить на три типа.
1. Соли, образованные слабыми кислотами и сильными основаниями (например, CH3COONa, K2S, Ca(NO2)2 и др.). В случае подобных соединений соль гидролизуется по аниону, а раствор приобретает щелочную реакцию (рН > 7). Так гидролиз ацетата натрия протекает по уравнению
CH3COONa + H2O  CH3COOH + NaOH
CH3COOH + NaOH
или
CH3COO- + H2O  CH3COOH + OH-
CH3COOH + OH-
2. Соли, образованные сильными кислотами и слабыми основаниями (например, NH4Cl, AlCl3, Zn(NO3)2 и др.). Для таких солей имеет место гидролиз по катиону, в результате чего раствор приобретает кислую реакцию (рН < 7). Например, гидролиз хлорида аммония описывается уравнениями
NH4Cl +H2O  NH3∙H2O + HCl;
NH3∙H2O + HCl;
NH 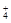 + H2O
+ H2O  NH3∙H2O + H+
NH3∙H2O + H+
Продуктом гидролиза является гидратированный аммиак.
3. Соли, образованные слабыми кислотами и слабыми основаниями (например, CH3COONH4, Al2S3, Fe(CH3COO)3 и др.). В этом случае гидролизу подвергаются и катион, и анион. Реакция среды будет определяться относительной силой образующихся кислоты и основания; раствор может быть нейтральным, слабокислым, слабощелочным. Так, ацетат аммония гидролизуется по уравнениям
CH3COONH4 + H2O  NH3∙H2O + CH3COOH;
NH3∙H2O + CH3COOH;
NH 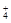 + CH3COO-
+ CH3COO-  NH3∙H2O + CH3COOH
NH3∙H2O + CH3COOH
Поскольку константы ионизации уксусной кислоты и гидратированного аммиака одинаковы (1,8∙10-5), раствор ацетата аммония имеет нейтральную реакцию.
Соли, образованные сильной кислотой и сильным основанием (например, хлорид натрия, сульфат калия), гидролизу не подвергаются.
Если катион или анион многозарядны, то гидролиз протекает ступенчато. Так катион алюминия гидролизуется в три стадии:
Al3+ + H2O  Al(OH)2+ + H+;
Al(OH)2+ + H+;
Al(OH)2+ + H2O  Al(OH)
Al(OH)  + H+;
+ H+;
Al(OH)  + H2O
+ H2O  Al(OH)3 + H+
Al(OH)3 + H+
В таком случае доминирующей обычно является первая стадия, т.е. гидролиз иона с максимальным значением заряда, причем процесс этот обратим. Однако в некоторых случаях при растворении соли может наблюдаться полный гидролиз, сопровождающийся превращением соли в соответствующие кислоту и основание. Полному гидролизу подвергаются соли, образованные очень слабыми кислотой и основанием, особенно если один из продуктов гидролиза выделяется в виде газа. Так, например, сульфид алюминия не может существовать в водных растворах в связи с количественным протеканием реакции
Al2S3 + 6H2O  2Al(OH)3¯ + 3H2S
2Al(OH)3¯ + 3H2S
Количественно процесс гидролиза характеризуют степенью и константой гидролиза. Степенью гидролиза называется отношение числа подвергшихся гидролизу частиц (Nгидр) к общему числу частиц (N):

Константа гидролиза представляет собой константу равновесия реакции обменного взаимодействия соли с водой. Пусть гидролизу подвергается соль XY, диссоциирующая на катион X + и анион Y-. Уравнение константы гидролиза этой соли будет зависеть от типа гидролиза:
а) соли, гидролизующиеся по катиону:
Х+ + Н2О  ХОН + Н+,
ХОН + Н+,
Kгидр 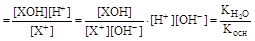 ;
;
б) соли, гидролизующиеся по аниону:
Y- + H2O  HY + OH-,
HY + OH-,
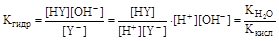 ;
;
в) соли, гидролизующиеся по катиону и аниону:
X+ + Y- +H2O  HY + XOH,
HY + XOH,
 ;
;
где Ккисл и Косн - константы ионизации кислоты и основания. При выводе уравнений констант гидролиза допускалось, что концентрация воды в растворе постоянна. Как следует из полученных уравнений, соль тем сильнее гидролизуется, чем меньше Ккисл и Косн, т.е. чем слабее кислота и основание, образующие соль.
Константа и степень гидролиза связаны соотношением, аналогичным уравнению закона разбавления:


На смещение гидролитических равновесий влияют концентрация раствора и температура. Так, для карбоната натрия, гидролизующегося по уравнению
Na2CO3 + H2O  NaHCO3 + NaOH,
NaHCO3 + NaOH,
или
СО32- + Н2О  НСО3- + ОН-,
НСО3- + ОН-,
степень гидролиза при 25˚С с изменением концентрации раствора от 0,1 моль/л до 0,001 моль/л возрастает от 2,7% до 34%.
Реакции гидролиза эндотермичны, поэтому, в соответствии с принципом Ле Шателье, при нагревании гидролиз усиливается. Например, для хлорида хрома(III) в децимолярном растворе степень гидролиза по уравнению
Cr3+ + H2O  Cr(OH)2+ +H+
Cr(OH)2+ +H+
при 0˚С составляет 4 %, а при 100˚С – 42 %. При нагревании могут реализоваться более высокие ступени гидролиза, чем при низких температурах. Так, ацетат железа(III) при комнатной температуре гидролизуется по уравнению
Fe3+ + CH3COO- + H2O  Fe(OH)2+ + CH3COOH
Fe(OH)2+ + CH3COOH
Однако при нагревании раствора этой соли происходит образование осадка по уравнению
Fe3+ + 3CH3COO- + 2H2O  Fe(OH)2CH3COO↓ +2CH3COOH
Fe(OH)2CH3COO↓ +2CH3COOH
Расчет константы и степени гидролиза, а также рНводных растворов солей рассмотрим на конкретных примерах.
Пример № 1. Сантимолярный раствор (0,01 моль/л) хлорида аммония (соль, образованная слабым основанием и сильной кислотой). Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
NH4+ + H2O  NH3×H2O + H+
NH3×H2O + H+

Умножив числитель и знаменатель правой части равенства на концентрацию гидроксид-ионов, константу гидролиза можно преобразовать следующим образом:


 = 5,56×10-10
= 5,56×10-10
Из уравнения гидролиза следует, что [NH3×H2O] = [H+] = Ch, а [NH4+] = C - Ch = C(1-h). Соответственно,

Так как h << 1, а (1-h) ® 1, полученное выражение можно упростить:
 ; отсюда h»
; отсюда h» 
 » 2,36×10-4 или 0,0236%
» 2,36×10-4 или 0,0236%
При расчете величины рН раствора соли учтем, что [NH3×H2O] = [H+], а в первом приближении [NH4+]» C.
 ; отсюда [H+]»
; отсюда [H+]» 
pH = - lg[H+] = -1/2(lgKw + lgC + pKb) = 7 - 1/2(pKb + lgC) = 7 - 1/2(4,76 - 2) = 5,62
Пример № 2. Сантимолярный раствор (0,01 моль/л) ацетата натрия (соль, образованная сильным основанием и слабой кислотой). Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
CH3COO- + H2O  CH3COOH + OH-
CH3COOH + OH-

Умножив числитель и знаменатель правой части равенства на концентрацию катиона водорода, его можно преобразовать к следующему виду:
 = 1×10-14/1,75×10-5 = 5,71×10-10
= 1×10-14/1,75×10-5 = 5,71×10-10
Из уравнения гидролиза следует, что [CH3COOH] = [OH-] = Ch, а [CH3COO-] = C - Ch = C(1-h).
Соответственно,
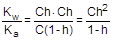 ;
;  ; отсюда h =
; отсюда h = 
 » 2,39×10-4 или 0,0239%
» 2,39×10-4 или 0,0239%
При расчете величины рН учтем, что [CH3COOH] = [OH-], а [CH3COO-]» C.
 ; отсюда [OH-]»
; отсюда [OH-]»  ;
;
pOH = -lg[OH-] = -1/2(lgKw + lgC + pKa) = 7 - 1/2(pKa + lgC)
pH = 14 - pOH = 7 + 1/2(pKa + lgC) = 7 + 1/2(4,75 - 2) = 9,75
Пример № 3. Сантимолярный раствор (0,01 моль/л) ацетата аммония (соль, образованная слабым основанием и слабой кислотой). Запишем уравнение гидролиза в ионной форме и составим выражение для константы гидролиза.
NH4+ + CH3COO- + H2O  NH3×H2O + CH3COOH
NH3×H2O + CH3COOH

Умножив числитель и знаменатель правой части равенства на произведение концентрации катиона водорода и гидроксид-аниона (ионное произведение воды), его можно преобразовать следующим образом:
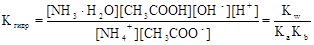 =
=  = 0,32×10-4
= 0,32×10-4
Из уравнения гидролиза следует, что [CH3COOH] = [NH3×H2O] = Ch, тогда
[CH3COO-] = [NH4+] = C - Ch = C(1-h), соответственно, 
Отсюда  ;
;
 = 0,0056 или 0,56%
= 0,0056 или 0,56%
Образующаяся в результате гидролиза гидратированная молекула аммиака диссоциирует, отщепляя гидроксид-анион:
NH3×H2O  NH4+ + OH-
NH4+ + OH-
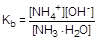 ; отсюда
; отсюда 
Аналогично, диссоциация уксусной кислоты обеспечивает образование катионов водорода:
CH3COO- + H+  CH3COOH
CH3COOH
 ; отсюда
; отсюда 
Найдем отношение концентраций данных ионов:
 :
: 
Согласно уравнению гидролиза [CH3COOH] = [NH3×H2O], а [CH3COO-] = [NH4+], тогда 
Так как [OH-] = Kw/[H+], то [H+]2 = 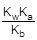 ; отсюда [H+] =
; отсюда [H+] = 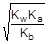
pH = - lg[H+] = 1/2(pKw + pKa - pKb) = 7 + 1/2(pKa - pKb) = 7 + 1/2(4,75 - 4,76) = 6,995
Поиск по сайту: