 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Классификация координационных соединений
Координационные соединения исключительно разнообразны, а число их теоретически бесконечно велико. Действительно, способность к комплексообразованию присуща почти всем химическим элементам, а в качестве лигандов могут выступать как неорганические, так и органические молекулы и ионы. В результате число возможных координационных соединений многократно больше числа простых органических и неорганических соединений. Многообразие координационных соединений требует четкой классификации этих химических объектов.
Существует несколько систем классификации координационных соединений, отличающихся по тому, какой признак положен в основу классификации. Важнейшими классификационными признаками являются:
Заряд комплекса. По этому признаку координационные соединения делятся на 4 группы:
1. Координационные соединения - неэлектролиты. Внутренняя (координационная) сфера соединений данного типа не имеет заряда, внешнесферные ионы отсутствуют. Примером подобных соединений могут служить [Pt(NH3)2Cl2], [Co(NH3)3(CN)3] и др.
2. Катионные комплексы. В состав соединения входит комплексный катион, заряд которого компенсируется простыми внешнесферными анионами. Примером таких соединений могут служить [Co(NH3)6]Cl3, [Cr(NH3)6]Br3 и др.
3. Анионные комплексы. Соединение состоит из комплексного аниона и простых внешнесферных катионов (например, K3[Fe(CN)6], K2[HgI4] и др.).
4. Катионно-анионные координационные соединения. И катион, и анион соединения являются комплексными ионами (например, [Cu(NH3)4][PtCl4], [Cr(H2O)6][Co(CN)6] и др.).
Координационные соединения 1 группы называют неионогенными, 2 - 4 групп - ионогенными.
Число центральных атомов (ядерность). Соединения подразделяются на группы по числу центров координации во внутренней координационной сфере. Различают:
1. Моноядерные комплексы. Внутренняя координационная сфера имеет один центр координации (например, [Fe(CO)5], или [Ni(NH3)6]Br2).
2. Биядерные комплексы. Внутренняя координационная сфера имеет два центральных атома (два центра координации), например, [Mn2(CO)10], или [(NH3)4Co(OH)2Co(NH3)4](SO4)2.
3. Полиядерные комплексы. Имеют более двух центров координации, например, [Со4(СО)12].
Биядерные и полиядерные комплексы могут быть мостиковыми и безмостиковыми. В случае мостиковых комплексов во внутренней координационной сфере имеются лиганды, связывающие два и более центральных атома. Таков, например, комплекс [(NH3)4Co(OH)2Co(NH3)4]4+, в котором функцию мостиков выполняют гидроксид-ионы.
В безмостиковых комплексах центральные атомы связаны между собой непосредственно. Так, в комплексе [Re2Cl8]2- атомы рения связаны между собой четверной связью, и каждый из них координирует 4 иона хлора (см. раздел 5.2.4). Подобные комплексы, в которых реализуются ковалентные связи металл-металл, называются кластерами.
Природа лигандов. Центральные атомы координационных соединений могут координировать как одинаковые лиганды (гомолигандные комплексы), так и лиганды различные (гетеролигандные комплексы). Гомолигандые комплексы в зависимости от природы лиганда подразделяются на ряд типов. Важнейшими из них являются:
1. Аквакомплексы. Лигандами являются молекулы воды (например, [Al(H2O)6]Cl3, [Be(H2O)4]SO4 и др.).
2. Амминокомплексы (аммиакаты). Функцию лиганда выполняют молекулы аммиака (например, [Co(NH3)6]Cl3, [Cu(NH3)4](OH)2 и др.).
3. Гидроксокомплексы. Центральный атом координирует гидроксид-анион (например, Na3[Al(OH)6], K2[Be(OH)4]).
4. Ацидокомплексы. Содержат в качестве лигандов анионы кислотных остатков (например, K3[Fe(CN)6], Na3[AlF6]).
5. Комплексные гидриды. Лиганд - отрицательный ион водорода. Примером гидридных комплексов могут служить гидридоалюминаты и гидридобораты (Li[AlH4], K[BH4]).
6. Карбонилы. Координационные соединения, в которых роль лигандов выполняют молекулы оксида углерода(II) (например, [Ni(CO)4], [Fe2(CO)9], [Fe3(CO)12]).
7. Пи-комплексы (p-комплексы), в которых центральный атом координирует лиганд за счет делокализованных кратных связей или ароматической системы, например:

бис(циклопентадиенил)железо(II), ферроцен
Наличие или отсутствие циклов во внутренней сфере. В этом плане различают:
1. Ациклические комплексы. Центральный атом и лиганд образуют фрагмент открытой цепи (например, [Cu(NH2C2H5)4]SO4).
2. Хелаты. Координационные соединения, содержащие во внутренней координационной сфере циклы, включающие центральный атом. Так, например, хелатом является комплекс меди с этилендиамином
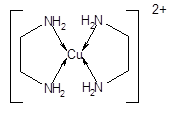
содержащий два пятичленных цикла, включающих атом меди. Хелаты образуют только бидентатные и полидидентатные лиганды.
Если лиганд содержит как нейтральные, так и отрицательно заряженные электрондонорные группы, полностью нейтрализующие заряд центрального атома, то такие хелаты-неэлектролиты называются внутренними координационными соединениями или внутрикомплексными солями. Внутрикомплексной солью, например, является хелат, образуемый катионом Cu2+ c анионом аминоуксусной кислоты и других a-аминокислот.
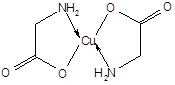
Поиск по сайту: