 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Теория сильных электролитов
Рассмотренные выше закономерности, присущие слабым электролитам, не могут быть распространены на растворы сильных электролитов. В частности, сильные электролиты не подчиняются закону разбавления Оствальда. Так, для хлорида натрия расчетные значения константы диссоциации при концентрациях, равных 0,1, 1,0 и 4,0 моль/л, составляют 0,27, 1,25 и 12,0, т.е. монотонно возрастают с увеличением концентрации раствора.
Теория, объясняющая поведение растворов сильных электролитов, была разработана П. Дебаем и Э. Хюккелем (1923 г.). В основе этой теории лежат следующие положения:
1. Реальная степень диссоциации сильных электролитов не зависит от концентрации и равна единице.
2. В растворах сильных электролитов имеет место электростатическое межионное взаимодействие. В результате вокруг каждого иона образуется атмосфера из ионов противоположного знака: в непосредственной близости от катиона появляются преимущественно анионы и наоборот.

Поскольку каждый ион одновременно входит в состав ионной атмосферы другого иона, межионное взаимодействие препятствует перемещению ионов в растворе, что влияет на физические свойства системы. Так, при пропускании через раствор электрического тока анионы будут тормозить перемещение катионов к катоду, а катионы - перемещение анионов к аноду. В результате наблюдаемая электропроводность раствора будет меньше величины, отвечающей полной диссоциации электролита в растворе.
3. Непосредственное измерение степени диссоциации сильного электролита дает не истинную, а кажущуюся степень диссоциации
αкаж ≤ αист = 1
Первоначально полагали, что в растворах сильных электролитов вообще нет ионных агрегатов. Однако позже было установлено, что в концентрированных растворах может иметь место ассоциация ионов. Агрегаты, образованные гидратированными ионами, называют ионными парами. Естественно, ионные пары по строению, свойствам и механизму образования не тождественны молекулам слабых электролитов.
Как указывалось выше, растворы сильных электролитов не подчиняются закону действующих масс. Выделить и количественно охарактеризовать каждый из факторов, обусловливающих это явление, не представляется возможным. Однако можно учесть суммарное влияние всех этих факторов, введя в теорию растворов представление об активности (Г. Льюис, 1907 г.).
Активность - это эффективная концентрация частицы, т.е. концентрация, соответственно которой частица проявляет себя в растворе.
Уравнения, базирующиеся на законе действующих масс, могут быть распространены на растворы сильных электролитов, если концентрации частиц, входящих в эти уравнения, заменить их активностями. Активность (а) связана с концентрацией уравнением
а = f .C
С - концентрация иона, соответствующая полной диссоциации электролита, f - коэффициент активности - параметр, суммарно отражающий результат взаимодействия всех силовых полей, возникающих в растворе. Коэффициенты активности в общем случае устанавливают экспериментально. В очень разбавленных растворах (С < 0,01 моль/л) коэффициенты активности мало зависят от природы иона и определяются только зарядом этого иона и ионной силой раствора. Ионной силой раствора (μ) называется полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат заряда этих ионов (z).
μ = 0,5ΣСizi2
Ионная сила и коэффициент активности для разбавленных растворов связаны уравнением Дебая-Хюккеля:

Рассчитаем в качестве примера активности ионов в 0,01М растворе сульфата калия. В соответствии с уравнением
K2SO4 = 2K+ + SO 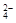
концентрации ионов калия и сульфат-иона в растворе составляет 0,02 и 0,01 моль/л, а ионная сила
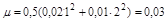
Тогда


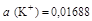 моль/л;
моль/л;
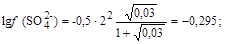

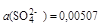 моль/л
моль/л
Коэффициенты активности зависят от концентрации электролита и от температуры. Концентрационная зависимость коэффициента активности весьма сложна. В случае разбавленных и умеренно концентрированных растворов (С < 0,5 моль/л) коэффициент активности растет при разбавлении раствора, приближаясь к единице. Однако в концентрированных растворах может наблюдаться обратное явление: коэффициент активности при увеличении концентрации раствора возрастает и даже становится больше единицы. Например, для растворов гидроксида калия наименьшее значение коэффициента активности, равное 0,728, отвечает раствору, содержащему 0,500 моль/л КОН; уменьшение концентрации до 0,050 моль/л сопровождается повышением коэффициента активности до 0,824, тогда как при изменении концентрации от 0,500 до 4,00 моль/л коэффициент активности возрастает от 0,728 до 1,35. Увеличение коэффициента активности при разбавлении связано с ослаблением межионного взаимодействия в результате увеличения среднего расстояния между частицами. Причины, вызывающие возрастание коэффициента активности для концентрированных растворов, до настоящего времени не ясны. На коэффициент активности влияет также температура; с повышением температуры коэффициент активности в случае разбавленных растворов понижается, в случае концентрированных - повышается.
Метод активностей позволяет дать количественное описание свойств значительно более широкой совокупности растворов, чем классическая теория электролитической диссоциации. Однако не следует забывать, что коэффициент активности - эмпирический коэффициент, в силу чего этот подход носит формальный характер и, позволяя решать разнообразные практические задачи, мало что дает для понимания сущности процессов, протекающих в растворах.
Поиск по сайту: