 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Электролиз
|
Читайте также: |
Пропуская через раствор или расплав электролита электрический ток, можно осуществлять окислительно-восстановительные реакции, которые не протекают самопроизвольно.
Процесс раздельного окисления и восстановления на электродах, осуществляемый за счет протекания электрического тока от внешнего источника, называется электролизом.
При электролизе анодом является положительный электрод, на котором протекает процесс окисления, а катодом - отрицательный электрод, на котором осуществляется процесс восстановления. Названия "анод" и "катод", таким образом, не связаны с зарядом электрода: при электролизе анод положителен, а катод отрицателен, а при работе гальванического элемента - наоборот. В процессе электролиза анод является окислителем, катод - восстановителем.
Количественно процесс электролиза описывают законы М. Фарадея (1833 г.):
1. Масса выделившегося на электроде вещества пропорциональна количеству электричества, прошедшего через раствор или расплав.
2. Для выделения на электроде одного моля эквивалентов любого вещества затрачивается одно и то же количество электричества.
Обобщенно законы Фарадея выражаются следущим уравнением:
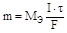
где m - масса продукта электролиза, I - сила тока, t - время пропускания тока, F - константа, равная 96485 Кл.моль-1 (число Фарадея), Мэ - эквивалентная масса вещества.
Как уже указывалось, электролизу подвергаются как растворы, так и расплавы электролитов. Наиболее просто протекает электролиз расплавов. В этом случае на катоде происходит восстановление катиона, а на аноде - окисление аниона электролита. Например, электролиз расплава хлорида натрия протекает по уравнениям:
Катодный процесс: Na+ + 1e- = Na | 2
Анодный процесс: 2Cl- - 2e- = Cl2 | 1
Уравнение электролиза: 2NaCl = 2Na + Cl2
Электролиз растворов протекает значительно сложней, так как в этом случае электролизу могут подвергаться молекулы воды. При электролизе вода может и окисляться, и восстанавливаться соответственно следующим полуреакциям.
1) Восстановление воды (катодный процесс)
2Н2О + 2е- = Н2 + 2ОН-; Е˚ = -0,83 В
2) Окисление воды (анодный процесс)
2Н2О - 4е- = 4Н+ + О2; Е˚ = 1,23 В
(Здесь и в дальнейшем приводятся значение Е˚, отвечающие превращению окисленной формы в восстановленную). Поэтому при электролизе водных растворов наблюдается конкуренция между электродными процессами с различными значениями электродных потенциалов. При этом в идеальном случае на катоде должна протекать полуреакция с наибольшим значением электродного потенциала, а на аноде - полуреакция с наименьшим значением электродного потенциала. Однако для реальных процессов значение электродных потенциалов - не единственный фактор, влияющий на характер взаимодействия.
В идеальном случае для того, чтобы электролиз начался, необходимо приложить к системе внешнюю ЭДС, превышающую на бесконечно малую величину (ΔU) ЭДС гальванического элемента, построенного на данной ОВР. Однако в действительности напряжение, необходимое для начала электролиза, будет несколько больше. Это явление обусловливают относительно медленная диффузия ионов к электроду, адсорбционные процессы, десорбция газообразных продуктов электролиза и т.д. Добавочная ЭДС, необходимая для начала процесса электролиза на электродах, называется перенапряжением. Перенапряжение складывается из перенапряжения на катоде (ΔЕкат) и перенапряжения на аноде (ΔЕан). Для большинства металлов значения перенапряжения невелики; исключением являются железо (ΔЕ = 0,24 В) и никель (ΔЕ = 0,23 В). Высокое перенапряжение отвечает кислороду (порядка 0,5 В) и особенно водороду, для которого перенапряжение может достигать 0,7 - 1,6 В в зависимости от металла, на котором выделяется водород.
В большинстве случаев выбор между конкурирующими реакциями при электролизе можно сделать на основании следующих правил:
1. Если металл в ряду стандартных электродных потенциалов стоит правее водорода, то на катоде восстанавливается металл.
2. Если металл в ряду стандартных электродных потенциалов стоит левее алюминия (включительно), на катоде выделяется водород за счет восстановления воды.
3. Если металл в ряду стандартных электродных потенциалов занимает место между алюминием и водородом, на катоде идет параллельное восстановление металла и водорода.
4. Если электролит содержит анионы кислородсодержащих кислот, гидроксила или фторид-анион, на аноде окисляется вода. Во всех остальных случаях на аноде окисляется анион электролита. Такой порядок окисления восстановителей на аноде объясняется тем, что полуреакции
F2 + 2e- =2F-
отвечает очень высокий электродный потенциал 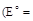 2,87 В), и она практически никогда не реализуется, если возможна другая конкурирующая реакция. Что же касается кислородсодержащих анионов, то продуктом их окисления является молекулярный кислород, которому соответствует высокое перенапряжение (0,5 В на платиновом электроде). По этой причине при электролизе водных растворов хлоридов на аноде окисляются ионы хлора, хотя электродный потенциал полуреакции
2,87 В), и она практически никогда не реализуется, если возможна другая конкурирующая реакция. Что же касается кислородсодержащих анионов, то продуктом их окисления является молекулярный кислород, которому соответствует высокое перенапряжение (0,5 В на платиновом электроде). По этой причине при электролизе водных растворов хлоридов на аноде окисляются ионы хлора, хотя электродный потенциал полуреакции
2Cl- - 2e- = Cl2; 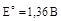
выше, чем электродный потенциал окисления воды (E0 = 1,23 В).
На процесс электролиза оказывает влияние также материал электрода. Различают инертные электроды, которые не изменяются в процессе электролиза (графит, платина), и активные электроды, подвергающиеся при электролизе химическим изменениям.
Рассмотрим некоторые примеры электролиза растворов.
Пример 1. Электролиз водного раствора сульфата меди(II) с инертными электродами.
CuSO4 = Cu2+ + SO 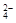
Катодный процесс: Cu2+ + 2e- = Cu; E˚ = 0,34 B | 2
Анодный процесс: 2H2O - 4e- = 4H+ + O2; E˚ = 1,23 B | 1
Уравнение электролиза: 2Cu2+ + 2H2O = 2Cu + 4H+ + O2
Или 2СuSO4 + 2H2O = 2Cu + 2H2SO4 + O2
Пример 2. Электролиз водного раствора сульфата меди с медным анодом.
Катодный процесс: Сu2+ + 2e- = Cu; E˚ = 0,34 B
Анодный процесс: Cu0 - 2e- = Cu2+; E˚ = 0,34 B
Электролиз сводится к переносу меди с анода на катод.
Пример 3. Электролиз водного раствора сульфата натрия с инертными электродами.
Na2SO4 = 2Na+ + SO 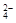
Kатодный процесс: 2H2O + 2e- = H2 + 2OH-; E˚ = -0,83 B | 2
Анодный процесс: 2H2O - 4e- = 4H+ + O2; E˚ = 1,23 B | 1
Уравнение электролиза: 2H2O = 2H2 + O2
Электролиз сводится к разложению воды.
Пример 4. Электролиз водного раствора хлорида натрия с инертным катодом.
NaCl = Na+ + Cl-
Катодный процесс: 2H2O + 2e- = H2 + 2OH-- = -0,83 B | 1
Анодный процесс: 2Cl- - 2e- = Cl2; E˚ = 1,36 B | 1
Уравнение электролиза: 2Cl-+ 2H2O = H2 + Cl2 + 2OH-
или 2NaCl + 2H2O = 2NaOH + H2 + O2
Электролиз широко используется в промышленности для получения ряда активных металлов (алюминия, магния, щелочных и щелочноземельных металлов), водорода, кислорода, хлора, гидроксида натрия, пероксида водорода, перманганата калия и ряда других практически важных веществ. Электролиз применяется также для защиты металлов от коррозии путем нанесения на защищаемый объект прочных металлических пленок.
Поиск по сайту: