 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Межмолекулярное взаимодействие
Экспериментальные данные свидетельствуют о том, что между молекулами любых простых и сложных веществ в газообразном, жидком и твердом состояниях наблюдается взаимное притяжение даже на относительно больших расстояниях, исключающих перекрывание электронных орбиталей и образование химических связей. Силы, обуславливающие данное взаимодействие, называются силами Ван-дер-Ваальса, а изменение энергии системы, обусловленное действием этих сил, - эффектом межмолекулярного взаимодействия. Следствием межмолекулярного взаимодействия является, в частности, переход газов в жидкости, а жидкостей - в кристаллические структуры. Межмолекулярное взаимодействие играет существенную роль в образовании растворов, в процессах диффузии и адсорбции.
Межмолекулярное взаимодействие отличается следующими особенностями:
1. Межмолекулярное взаимодействие является относительно слабым. Отвечающие ему тепловые эффекты на один-два порядка меньше тепловых эффектов образования ковалентных связей. Так, энергия связи для молекулы Н2 равна 432 кДж/моль, в то время как энтальпия сублимации кристаллического водорода, связанная с межмолекулярным взаимодействием, составляет 2,1 кДж/моль.
2. Межмолекулярное взаимодействие не является специфическим. Силы Ван-дер-Ваальса действуют между самыми разнообразными молекулами, одинаковыми или различными.
3. Силы Ван-дер-Ваальса имеют электростатическую природу, в связи с чем межмолекулярное взаимодействие является ненасыщаемым и ненаправленным.
Наряду с силами притяжения между молекулами могут действовать и силы отталкивания, обусловленные взаимодействием заполненных электронами орбиталей при сильном сближении частиц. Однако силы эти обычно весьма слабы и становятся значительными лишь при очень малых межмолекулярных расстояниях.
Можно выделить три вида межмолекулярного взаимодействия, каждый из которых вносит определенный вклад в изменение энергии системы.
1. Ориентационное взаимодействие. Обусловлено взаимодействием собственных дипольных моментов молекул и присуще веществам, молекулы которых полярны. В подобных веществах и смесях веществ молекулы ориентируются друг относительно друга так, чтобы их разноименные полюса максимально сближались. Действующие при этом силы называются ориентационными. Энергия ориентационного взаимодействия двух одинаковых молекул (ориентационный эффект) выражается следующим уравнением (В. Кеезом, 1912 г.).

где m - дипольный момент молекулы, r - расстояние между молекулами.
2. Индукционное взаимодействие. При сближении двух полярных молекул или полярной и неполярной молекул наблюдается взаимная поляризация частиц, сопровождающаяся возникновением индуцированных дипольных моментов, ориентированных друг к другу противоположными полюсами. Между частицами возникают дополнительные силы притяжения (индукционные силы), понижающие энергию системы. Величина индукционного эффекта может быть вычислена по следующему уравнению (П. Дебай, 1920 г.).
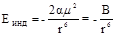
где a - поляризуемость молекулы.
3. Дисперсионное взаимодействие. Реализуется для всех видов молекул (в том числе и для одноатомных молекул благородных газов) и связано с взаимодействием мгновенных микродиполей вещества. Любая молекула является динамической системой. В результате движения электронов центры тяжестей зарядов ядер и электронов в любой момент времени могут не совпадать, в результате чего частица представляет собой мгновенный (временный) микродиполь. Время существования подобных диполей ничтожно мало. Однако, возникнув, временный диполь мгновенно индуцирует в ближайших молекулах диполи, определенным образом ориентированные относительно исходного. Появление и исчезновение временных диполей происходит непрерывно и синхронно, результатом чего является возникновение в системе дисперсионных сил притяжения между частицами вещества. Для двух одинаковых частиц дисперсионный эффект выражается следующим уравнением (Ф. Лондон, 1930 г.)
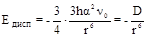
где h - постоянная Планка, n0 - частота колебаний молекул при температуре абсолютного нуля.
Вклады, вносимые каждым видом межмолекулярного взаимодействия в общий эффект, различны для различных молекул. Наименьший вклад вносит индукционное взаимодействие; величина Едисп обычно превышает Еор, хотя и не всегда. Для одноатомных молекул (He, Ne и т.д.) Еор и Еинд равны нулю. Значения отдельных энергетических эффектов и их суммы для некоторых молекул приведены в табл. 21.
Таблица 21
Ориентационный, индукционный и дисперсионный эффекты (кДж/моль)
для некоторых веществ
| Молекула | Еор | Еинд | Едис | Суммарная энергия |
| H2 | 0,17 | 0,17 | ||
| Ar | 8,48 | 8,48 | ||
| HCl | 3,34 | 1,00 | 16,72 | 21,06 |
| H2O | 36,32 | 1,92 | 8,98 | 47,22 |
| NH3 | 13,28 | 1,55 | 14,72 | 29,55 |
Поиск по сайту: