 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
Растворы - это однородные (гомогенные системы), состоящие из двух и более компонентов.
Растворы могут быть газообразными (например, воздух), твердыми (например, сплав золота и серебра) и жидкими. Наибольшее распространение и значение имеют, несомненно, жидкие растворы. Именно этой группе растворов посвящен данный раздел. Компоненты, образующие раствор, подразделяют на растворитель (один из компонентов) и растворенные вещества (остальные компоненты). Понятия "растворитель" и "растворенное вещество" в значительной мере условны. В качестве растворителя выбирают обычно тот компонент, который находится в том же агрегатном состоянии, что и раствор. Если этому критерию отвечают несколько компонентов, то растворителем считают то вещество, которого больше. Исключением является вода, которую обычно принимают за растворитель даже тогда, когда ее меньше, чем других жидких компонентов.
Поскольку состав раствора переменен, важнейшей характеристикой раствора является его концентрация. Концентрация раствора определяет количественное соотношение между его компонентами и указывает содержание растворенного вещества в единице массы или объема растворителя или раствора. Если раствор содержит несколько растворенных веществ, то каждому из них соответствует определенная концентрация.
Существует несколько способов выражения концентрации растворов, из которых важнейшими являются следующие:
1. Молярность - отношение количества растворенного вещества к объему раствора
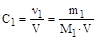 ,
,
где m1, M1 и ν1 - масса, молярная масса и количество растворенного вещества. В системе СИ единица молярности - моль/м3, однако химики предпочитают выражать молярную концентрацию в молях на литр. Молярность раствора обозначают также буквой М, перед которой пишут численное значение молярности. Так, запись 0,25 М H2SO4 соответствует раствору, в литре которого содержится 0,25 моля серной кислоты.
2. Нормальность раствора - отношение количества эквивалента растворенного вещества к объему раствора
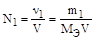 ,
,
где МЭ - эквивалентная масса растворенного вещества. Нормальность обозначают также буквой н, которой предшествует число, равное нормальности раствора (например, 0,01 н КОН).
3. Массовая доля - отношение массы растворенного вещества к массе раствора

Массовая доля выражается либо в долях единицы, либо в процентах.
4. Объемная доля - отношение объема растворенного вещества к сумме объемов компонентов раствора
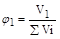
5. Мольная доля - отношение количества данного компонента к суммарному количеству всех компонентов раствора
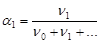
6. Моляльность - отношение количества растворенного вещества к массе растворителя. Моляльность обычно относят к 1 кг (1000 г) растворителя и рассчитывают по формуле
 ,
,
где m1 и m0 -массы растворенного вещества и растворителя, М1 - молярная масса растворенного вещества.
По своим свойствам растворы занимают промежуточное положение между смесями и химическими соединениями. Со смесями растворы сближают:
1) переменный состав, изменяющийся в более или менее широких пределах;
2) наличие у раствора свойств, присущих компонентам; так, например, натрий одинаково взаимодействует с водой и раствором сахарозы или хлорида натрия.
С химическими соединениями растворы сближает:
1) гомогенность;
2) наличие у растворов свойств, отсутствующих у компонентов; например, бесцветная вода и бесцветный безводный сульфат меди образуют раствор голубого цвета;
3) наличие тепловых эффектов при образовании раствора, которые могут быть как положительными, так и отрицательными; например, при растворении в воде серной кислоты температура раствора повышается, а при растворении нитрата аммония - понижается.
Двойственный характер свойств растворов объясняет гидратная (сольватная) теория растворов, основы которой были заложены в работах Д. И. Менделеева и развиты впоследствии И. А. Каблуковым и В. А. Кистяковским. Эта теория может быть сведена к следующим положениям:
1. При образовании раствора растворитель и растворенное вещество вступают в химическое взаимодействие, образуя непрочные соединения, называемые сольватами, а в случае воды - гидратами. Сольваты (гидраты) образуются в результате межмолекулярного взаимодействия, за счет образования водородных связей и ковалентных связей по донорно-акцепторному механизму. Чаще всего связь в сольватах имеет смешанный характер. В результате любой раствор является сложной гомогенной системой из частиц растворителя, растворенного вещества и продуктов их взаимодействия, образование которой сопровождается нарушением структуры растворителя (рис. 42).
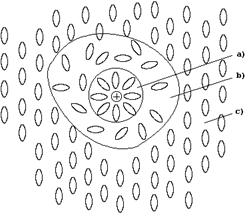
Рис. 42. Схематическое строение жидкого раствора:
а) зона сольватированной частицы растворенного вещества;
b) зона деструктированного растворителя;
c) зона структурированного растворителя.
2. Реакции сольватации (гидратации) заметно обратимы, и равновесия в растворах легко смещаются. В результате раствор сохраняет свойства растворителя и растворенного вещества.
3. Образование сольватов (гидратов) обусловливает появление у растворов свойств, отсутствующих у компонентов раствора; в частности, гидратированные ионы могут иметь иную окраску, чем те же ионы в кристалле вещества.
4. Тепловые эффекты, которыми сопровождается образование раствора, связаны с фазовыми переходами при образовании раствора и с протеканием процессов сольватации. Тепловой эффект, отвечающий растворению моля вещества в бесконечно большом количестве растворителя, называется энтальпией растворения (ΔНраств). Например, для серной кислоты ΔНраств составляет -96,2 кДж/моль, для нитрата аммония она равна 25,8 кДж/мол.
Поскольку растворы образуются самопроизвольно, в процессе растворения вещества свободная энергия системы должна понижаться, т.е.
ΔGраств < 0
где
ΔGраств =ΔНраств - ТΔSраств,
ΔSраств - изменение энтропии при образовании раствора.
Энтальпийный и энтропийный члены в уравнении можно представить как сумму двух слагаемых, одно из которых связано с фазовым переходом, а другое - с процессом сольватации
ΔНраств = ΔНфп + ΔНсольв,
ΔSраств = ΔSфп + ΔSсольв
При растворении кристаллических веществ ΔНфп = -Екр, где Екр - энергия кристаллической решетки, являющаяся положительной величиной.
В приведенных уравнениях ΔНсольв и ΔSсольв - отрицательные величины, так как при образовании сольватов энергия системы понижается, а упорядоченность ее возрастает, тогда как ΔНфп и ΔSфп - величины положительные, поскольку переход растворенного вещества в раствор сопровождается разрушением его структуры и повышением неупорядоченности системы. В результате значения ΔНраств и ΔSраств могут быть как положительными, так и отрицательными. При этом, если ΔНраств > 0, раствор образуется лишь в тех случаях, когда ΔSраств > 0.
5. Образование раствора сопровождается изменением объема системы сравнительно с суммой объемов растворителя и растворенного вещества. При этом величина  может быть как положительной, так и отрицательной. Так, объем раствора, содержащего 50 г воды и 50 г этилового спирта, составляет при стандартных условиях 109,9 мл, тогда как сумма объемов спирта и воды равна 113,5 мл. Образование раствора в этом случае сопровождается сжатием. Насыщенный раствор нитрата аммония содержит 68,19 масс.% NH4NO3; объем 100 г такого раствора равен 75,8 мл, а сумма объемов компонентов составляет 73,0 мл, т.е. образование раствора сопровождается расширением системы.
может быть как положительной, так и отрицательной. Так, объем раствора, содержащего 50 г воды и 50 г этилового спирта, составляет при стандартных условиях 109,9 мл, тогда как сумма объемов спирта и воды равна 113,5 мл. Образование раствора в этом случае сопровождается сжатием. Насыщенный раствор нитрата аммония содержит 68,19 масс.% NH4NO3; объем 100 г такого раствора равен 75,8 мл, а сумма объемов компонентов составляет 73,0 мл, т.е. образование раствора сопровождается расширением системы.
Раствор, для которого энтальпия растворения и изменение объема равны нулю, называется идеальным раствором.
Способность того или иного вещества переходить в раствор характеризует растворимость этого вещества. По способности к взаимной растворимости пáры веществ можно разделить на вещества с неограниченной растворимостью, например, этиловый спирт и вода, смешивающиеся в любых соотношениях, и вещества с ограниченной растворимость, например, вода и диэтиловый эфир. Для последней группы веществ количественной мерой растворимости является концентрация насыщенного раствора. Насыщенным называется раствор, находящийся в динамическом равновесии с избытком растворяемого вещества.
Для выражения растворимости может быть использован любой способ выражения концентрации (молярность, массовая доля, молярная доля и т.д.); часто для этой цели используют коэффициент растворимости k, равный массе растворенного вещества, образующей насыщенный раствор со 100 г растворителя при данной температуре. В зависимости от значения коэффициента растворимости вещества подразделяют на четыре группы:
1) легкорастворимые вещества, k>10 (например, H2SO4, NaOH, KNO3 в водных растворах);
2) умеренно растворимые вещества, 10>k>1 (например, Н3ВО3, Ba(NO3)2, HgCl2 в водных растворах);
3) малорастворимые вещества, 1>k>0,01 (например, PbCl2, Ag2SO4, TlCl);
4) практически нерастворимые вещества, k<0,01 (например, Cu(OH)2, BaSO4, AgI).
Следует отметить, что абсолютно нерастворимых веществ в природе не существует.
Растворимость вещества зависит от ряда факторов:
1. Природа растворителя и растворенного вещества.
В зависимости от этого фактора растворимость изменяется в чрезвычайно широких пределах. Так, например, при стандартных условиях растворимость хлорида калия в воде составляет 35,9 г на 100 г растворителя, тогда как растворимость того же вещества в бензоле практически равна нулю. В то же время в 100 г воды растворяется 0,002 г нафталина (С10Н8), а в 100 г бензола - 67,5 г. К сожалению, до настоящего времени нет единой теории, позволяющей количественно прогнозировать влияние природы веществ на растворимость. В этом плане более или менее удачно соблюдается правило: "Подобное растворяется в подобном". В соответствии с этим правилом вещества, образованные полярными молекулами или ионами, лучше растворяются в полярных растворителях, а вещества, молекулы которых неполярны, - в неполярных растворителях.
2. Температура.
Влияние температуры на растворимость зависит от агрегатного состояния растворяемого вещества.
В случае газов энтальпия фазового переход из газообразного состояния вещества в растворенное весьма мала. В силу этого процесс растворения газов в жидкостях является экзотермическим. Равновесие
вещество газообразное  вещество растворенное; ΔН<0
вещество растворенное; ΔН<0
в соответствии с принципом Ле Шателье при повышении температуры смещается в сторону обратного процесса, что приводит к понижению растворимости газа. Так, например, при стандартном давлении (1,013.105 Па) растворимость диоксида углерода в воде составляет при 0 оС 0,35 г, а при 15 оС - 0,20 г на 100 г воды.
Влияние температуры на растворимость жидкостей в жидкостях весьма своеобразно. Для одной и той же пары растворитель - растворенное вещество в определенных температурных интервалах возможно как повышение, так и понижение растворимости с ростом температуры. Так, никотин (C10H14N2) неограниченно растворим в воде при температурах ниже 61 оС и выше 208 оС. В интервале 61 < t oC < 208 вода и никотин образуют систему из двух жидких фаз, представляющих два взаимно насыщенных раствора. Например, при 80 оС один из этих растворов будет содержать 9,8 масс.%, а другой - 74,2 масс.% никотина. Температура, соответствующая переходу ограниченной растворимости в неограниченную, называется критической температурой растворения (верхней и нижней). Известны пáры жидкостей с одной критической температурой растворения (например, вода и анилин неограниченно растворимы при температурах, превышающих 160 оС) и вообще не имеющие критической температуры растворения (например, вода и диэтиловый эфир).
Растворимость твердых веществ в жидкостях с повышением температуры обычно повышается, причем иногда очень значительно. Так, коэффициент растворимости борной кислоты - Н3ВО3 - в воде при изменении температуры от 0 оС до 100 оС изменяется от 2,8 до 38,0 г. Однако для некоторых веществ повышение растворимости с ростом температуры незначительно. Например, для хлорида натрия в температурном интервале 0 - 100 оС коэффициент растворимости изменяется от 35,7 до 39,4 г. Известны вещества, растворимость которых понижается с повышением температуры. Такими веществами являются, в частности, сульфат и хромат кальция. Иногда температурная кривая растворимости проходит через максимум. Так, максимальная растворимость Na2SO4×10H2O (53 г соли на 100 г воды) отвечает 32 оС; дальнейшее повышение температуры сопровождается понижением растворимости. Подобные явления наблюдаются обычно тогда, когда при нагревании происходит изменение состава твердой фазы, находящейся в равновесии с раствором, в результате потери части или всей кристаллизационной воды.
3. Давление.
Давление особо сильно влияет на растворимость газа в жидкостях. Действительно, поскольку в системе жидкость - газ растворение газа сопровождается значительным уменьшением объема системы, повышение давления способствует увеличению растворимости газа. Количественно зависимость между давлением газа и его растворимостью выражается законом Генри: при постоянной температуре масса газа, растворяющегося в данном объеме жидкости, пропорциональна парциальному давлению газа над жидкостью.
Закон Генри является приближенным законом; наиболее строго ему следуют растворы малорастворимых газов при невысоких давлениях. Так, например, при 298 К коэффициент растворимости азота в воде составляет при 2,0·106 Па 0,00125 г, а при 4,0.106 Па - 0,00246 г.
Поскольку сжимаемость жидкостей и твердых веществ очень мала, давление слабо влияет на изменение растворимости этих веществ в жидкостях. Лишь в условиях очень высоких давлений (порядка 108 - 1010 Па) влияние этого фактора становится ощутимым. Поскольку ΔVраств может быть и отрицательной, и положительной, величиной, следует ожидать, что повышение давления может и повышать (если ΔVраств < 0), и понижать (если ΔVраств > 0) растворимость. Действительно, в случае нитрата аммония, для которого ΔVраств>0, повышение давления от 105 до 109 Па сопровождается понижением растворимости в два раза.
При контакте насыщенного раствора с растворяемым веществом процессы растворения и кристаллизации протекают с одинаковой скоростью (ΔG = 0), в силу чего при неизменяющихся условиях насыщенный раствор может существовать сколь угодно долго без изменения его концентрации. Однако для ряда веществ можно получить растворы, концентрация которых выше концентрации насыщенного раствора. Такие растворы называют пересыщенными растворами. Так, например, при нагревании кристаллического Na2S2O3.5H2O тиосульфат натрия растворяется в кристаллизационной воде. Если такой раствор медленно охладить до первоначальной температуры, кристаллизации тиосульфата натрия не наблюдается, так как последний образует пересыщенный раствор. В отличие от насыщенного, пересыщенный раствор не является равновесной системой. В этом случае система находится в неустойчивом (метастабильном) состоянии, для которого ΔG > 0. Поэтому даже при незначительном воздействии (встряхивание сосуда, внесение в раствор крупинки растворенного вещества) избыток растворенного вещества выкристаллизовывается из раствора, который при этом становится насыщенным.
Поиск по сайту: