 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Особенности ионной связи. Свойства ионных соединений
Ионная связь представляет собой предельный случай полярной связи, когда электроотрицательности взаимодействующих атомов настолько сильно отличаются друг от друга, что связывающая электронная пара полностью переходит от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью, следствием чего является превращение атомов в положительный и отрицательный ионы.
Рассмотрим в качестве примера образование ионной связи во фториде лития. Для этого вначале вспомним электронное строение взаимодействующих атомов и оценим их валентные возможности. Атом лития имеет электронную формулу 1s22s1. Очевидно, что для достижения устойчивой структуры ему необходимо отдать один электрон, расположенный на внешнем энергетическом уровне.
Li ® Li+ + e-
1s22s1 ® 1s2 + е-
Атому фтора, который имеет электронную формулу 1s22s22p5, для достижения устойчивой конфигурации электронной оболочки достаточно присоединить один электрон, источником которого является атом лития:
F + e- ® F-
1s22s22p5 + e- ® 1s22s22p 6
Электростатическое притяжение образовавшихся ионов и приводит к образованию вещества с ионной связью:
Li + F ® Li+ + F- ® Li+F-
Следует отметить, что описанная картина несколько идеализирована. В реальности полного переноса электрона не происходит, что вызвано поляризующим действием катиона лития, за счет которого он оттягивает на себя часть электронной плотности аниона. Квантово-механический расчет показывает, что в молекуле фторида лития эффективный заряд на атоме лития составляет +0,51, соответственно на атоме фтора -0,51, т.е. связь литий-фтор в значительной мере ковалентна.
Электростатическая природа ионной связи обуславливает ее основные свойства - ненаправленность и ненасыщаемость. Ненаправленность ионной связи обусловлена сферической симметрией электростатического поля иона, вследствие которой заряженная частица притягивает ионы противоположного знака равномерно по всем направлениям.
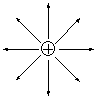
Образование ионной связи с частицей противоположного заряда нарушает сферическую симметрию поля, но само поле не исчезает. Поэтому, образовав одну ионную связь, ион не утрачивает способность к электростатическому взаимодействию с другими частицами.
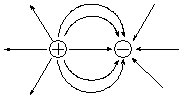
Вследствие этого молекулы с ионным типом связи существуют только при высокой температуре в газовой фазе. В конденсированном состоянии ионы стремятся окружить себя максимальным число ионов противоположного знака, что приводит к образованию веществ с немолекулярной структурой - ионных агрегатов (ионных кристаллов).
Общий тип химической связи обуславливает некоторые общие свойства, присущие всем ионным соединениям:
1. Ионные соединения имеют высокую температуру плавления и низкую летучесть. Это явление объясняется сильным электростатическим притяжением между катионами и анионами в соединении. Так, в кристалле хлорида цезия ион цезия окружают восемь ионов хлора, находящихся на кратчайшем расстоянии от него, а каждый ион хлора - восемь ионов цезия.
2. Ионные соединения, как правило, имеют низкую электрическую проводимость в кристаллическом состоянии, так как ионы, находящиеся в узлах кристаллической решетки, не способны к поступательному движению. В расплавах ионы такую способность обретают, в результате чего расплавы ионных соединений хорошо поводят электрический ток.
3. Ионные кристаллы тверды, но хрупки. Твердость ионных соединений объясняется отсутствием в них направлений, по которым кристаллическая решетка могла бы расслаиваться, как, например, в случае кристалла графита. Хрупкость ионных кристаллов связана с тем, что даже незначительные деформации решетки сопровождаются сближением одноименно заряженных ионов, в результате чего баланс сил отталкивания и притяжения нарушается, а кристалл раскалывается.
4. Ионные соединения обычно заметно растворимы в полярных растворителях. Полярные растворители характеризуются высокими значениями диэлектрической постоянной, которая связана с энергией взаимодействия двух заряженных частиц уравнением
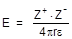
где Z+ и Z- - заряды взаимодействующих частиц, r - расстояние между ними, e - диэлектрическая постоянная среды. Для воды диэлектрическая постоянная составляет 7,25×10-10 Кл2×Дж-1×м-1, тогда как диэлектрическая постоянная вакуума (e0) равна 8,85×10-12 Кл2×Дж-1×м-1, то есть в 82 раза меньше. Изменение диэлектрической постоянной при переходе от вакуума к воде в 82 раза понижает энергию взаимодействия, что способствует распаду вещества на ионы. Примером других жидкостей с высокими значениями диэлектрической проницаемости могут служить циановодород (158 e0), фтороводород (83,6 e0), муравьиная кислота (57,9 e0), метиловый спирт (37,9 e0), жидкий аммиак (25,0 e0).
Повышению растворимости ионных соединений в полярных растворителях может благоприятствовать также сольватация образующихся ионов, являющаяся экзотермическим процессом.
Поиск по сайту: