 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Метод молекулярных орбиталей
Метод молекулярных орбиталей является наиболее строгой и результативной теорией, объясняющей строение и свойства координационных соединений. Этот подход, однако, значительно сложнее теории кристаллического поля и связан с определенными расчетными трудностями.
При описании координационных соединений по методу МО прежде всего выделяют атомный базис - набор атомных орбиталей центрального атома и лигандов, используемых в конструировании молекулярных орбиталей комплекса. Далее для каждой орбитали центрального атома строится так называемая групповая орбиталь лигандов (ГОЛ), представляющая собой комбинацию атомных орбиталей лигандов, имеющую ту же симметрию, что и орбиталь центрального атома, и перекрывающаяся с ней. Линейно комбинируя орбитали центрального атома и соответствующие ГОЛ, получают набор связывающих и разрыхляющих орбиталей комплекса. Если для каких-то орбиталей центрального атома сконструировать ГОЛ невозможно, эти орбитали переходят в набор молекулярных волновых функций как несвязывающие орбитали. После этого строят энергетическую диаграмму, на которой распределяют электроны.
Рассмотрим в качестве примера применение метода МО для не содержащих p-связей октаэдрических комплексов d-элементов. К таким комплексам можно отнести комплекс [Co(NH3)6]3+. Поскольку в молекуле аммиака неподеленная пара находится на sp3-гибридной орбитале, образование p-связей между азотом и кобальтом невозможно. В атомный базис такого комплекса войдут 9 атомных орбиталей центрального атома (4s, 4px, 4py, 4pz 3  , 3
, 3  , 3dxy, 3dxz, 3dyz) и 6 орбиталей лигандов, которые мы обозначим символами s1, s2... s6. Таким образом, число конструируемых молекулярных орбиталей также должно равняться 15.
, 3dxy, 3dxz, 3dyz) и 6 орбиталей лигандов, которые мы обозначим символами s1, s2... s6. Таким образом, число конструируемых молекулярных орбиталей также должно равняться 15.
Поместим атом кобальта в центре координат, а лиганды расположим на координатных осях так, как это показано на рис. 31,а. Для каждого лиганда координатная ось направлена от лиганда к центральному атому. На рисунке представлены также групповые орбитали лигандов, соответствующие по симметрии атомным орбиталям центрального атома. Как следует из рис. 31,б, орбиталь 4s, имеющая сферическую симметрию, одинаково перекрывается с орбиталями всех шести лигандов; это перекрывание будет положительным, если все орбитали взяты со знаком плюс. Отсюда групповая орбиталь лигандов выразится уравнением:
ГОЛ(s) = с1(s1+s2+s3+s4+s5+s6)
где с1 – нормировочный множитель. Комбинируя орбитали 4s и ГОЛ(s), получим s  (исходные орбитали складываются) и s
(исходные орбитали складываются) и s 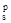 (орбиталь ГОЛ(s) вычитается из орбитали 4s).
(орбиталь ГОЛ(s) вычитается из орбитали 4s).
Орбиталь 4рх перекрывается только с s1- и s3-орбиталями (рис. 31,в), причем положительное перекрывание наблюдается, если орбиталь s1 взята со знаком плюс, а s2 - со знаком минус. Аналогичное перекрывание (только с другими парами s-орбиталей) имеет место для орбиталей 4рy и 4рz, что приводит к уравнениям:
ГОЛ(px) = с2(s1 - s3)
ГОЛ(py) = с2(s2 - s4)
ГОЛ(pz) = с2(s5 - s6)
(N = 1/Ö2). Линейное комбинирование ГОЛ(р) и 4р-орбиталей даст три связывающие и три разрыхляющие орбитали (s  , s
, s  , s
, s  , s
, s  , s
, s  ,s
,s 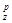 ).
).
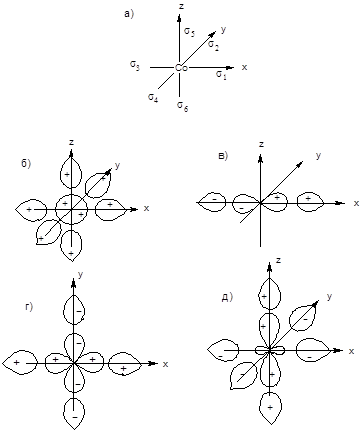
Рис. 31. Групповые орбитали лигандов в октаэдрическом комплексе и соответствующие им по симметрии
орбитали центрального атома
Для орбитали 3d  , как следует из рис. 31,г,
, как следует из рис. 31,г,
ГОЛ(d  ) = с3(s1 + s3 - s2 - s4)
) = с3(s1 + s3 - s2 - s4)
из орбиталей 3d  и ГОЛ(3d
и ГОЛ(3d  ) конструируют орбитали s
) конструируют орбитали s 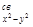 и s
и s 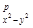 . Несколько сложнее обстоит дело с d
. Несколько сложнее обстоит дело с d  -орбиталью. В этом случае орбитали s5 и s6 вносят больший вклад в ГОЛ(d
-орбиталью. В этом случае орбитали s5 и s6 вносят больший вклад в ГОЛ(d  )-орбитали, чем орбитали s1, s2, s3, и s4. В соответствии с рис. 31,д, уравнение ГОЛ (d
)-орбитали, чем орбитали s1, s2, s3, и s4. В соответствии с рис. 31,д, уравнение ГОЛ (d  ) примет вид:
) примет вид:
ГОЛ(d  ) = с4(2s5 + 2s6 - s1 - s2 - s3 - s4)
) = с4(2s5 + 2s6 - s1 - s2 - s3 - s4)
Комбинирование этой волновой функции с 3d  -орбиталью дает орбитали s
-орбиталью дает орбитали s 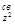 и s
и s  .
.
Для орбиталей 3dxy, 3dxz и 3dyz сконструировать ГОЛ невозможно. Поэтому указанные орбитали переходят в комплекс как несвязывающие орбитали p  , p
, p  и p
и p  .
.
Энергетическая диаграмма молекулярных орбиталей октаэдрического комплекса без p-связей приведена на рис. 32. Эти пятнадцать молекулярных орбиталей распределяются по семи энергетическим уровням, из которых два являются невырожденными, два - двукратно вырожденными и три - трехкратно вырожденными. Разность энергий s  -орбиталей и p
-орбиталей и p  -орбиталей (D) соответствует параметру расщепления для данного комплекса. Чем больше D, тем правее в спектрохимическом ряду располагается лиганд.
-орбиталей (D) соответствует параметру расщепления для данного комплекса. Чем больше D, тем правее в спектрохимическом ряду располагается лиганд.
Для того, чтобы описать тот или иной комплекс, необходимо распределить электроны этого комплекса по молекулярным орбиталям на энергетической диаграмме. При этом особо важным является распределение электронов по p  - и s
- и s  -орбиталям, так как от него зависит, будет ли комплекс высокоспиновым или низкоспиновым. В зависимости от значения D и энергии образования электронной пары (р) возможно либо образование электронных пар на орбиталях p
-орбиталям, так как от него зависит, будет ли комплекс высокоспиновым или низкоспиновым. В зависимости от значения D и энергии образования электронной пары (р) возможно либо образование электронных пар на орбиталях p  (р > D), либо заполнение орбиталей p
(р > D), либо заполнение орбиталей p  и s
и s  неспаренными электронами (р < D). Так, например, для комплекса [Co(NH3)6]3+ на молекулярных орбиталях необходимо распределить 18 электронов (6 от иона Сo3+, имеющего конфигурацию d6, и 12 от шести молекул аммиака, каждая из которых предоставляет для взаимодействия электронную пару). В связи с высоким значением D для аммиака рассматриваемому комплексу будет отвечать электронная формула (s
неспаренными электронами (р < D). Так, например, для комплекса [Co(NH3)6]3+ на молекулярных орбиталях необходимо распределить 18 электронов (6 от иона Сo3+, имеющего конфигурацию d6, и 12 от шести молекул аммиака, каждая из которых предоставляет для взаимодействия электронную пару). В связи с высоким значением D для аммиака рассматриваемому комплексу будет отвечать электронная формула (s  )2(s
)2(s  )6(s
)6(s  )4 (p
)4 (p  )6, а сам комплекс будет низкоспиновым. В то же время комплексу [CoF6]3- соответствует электронная формула (s
)6, а сам комплекс будет низкоспиновым. В то же время комплексу [CoF6]3- соответствует электронная формула (s  )2(s
)2(s  )6(s
)6(s  )4 (p
)4 (p  )4(s
)4(s  )2 в связи с малой величиной D для иона фтора. Этот комплекс, имеющий 4 неспаренных электрона, будет высокоспиновым.
)2 в связи с малой величиной D для иона фтора. Этот комплекс, имеющий 4 неспаренных электрона, будет высокоспиновым.

Рис. 32. Энергетическая диаграмма молекулярных орбиталей для октаэдрического комплекса
(без учета p-связей)
Поиск по сайту: