 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Химическая связь. Валентный угол - это угол, образуемый условными прямыми, проведенными через ядра центрального и присоединенных к нему атомов
Валентный угол - это угол, образуемый условными прямыми, проведенными через ядра центрального и присоединенных к нему атомов.
Внутренняя и внешняя гибридизация. Гибридизация с привлечением d-орбиталей предвнешнего энергетического уровня называется внутренней. Внешней гибридизацией называется гибридизация с использованием d-орбиталей внешнего уровня.
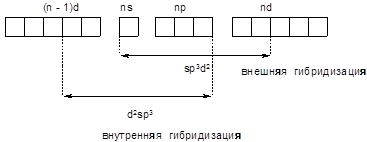
Водородная связь – это связь атома водорода, связанного с сильно электроотрицательным партнером, с атомами других элементов.
Гибридизация – выравнивание энергии и симметрии атомных орбиталей за счет комбинирования их волновых функций при образовании химических связей.
Длина связи – среднее расстояние между ядрами взаимодействующих атомов.
Дисперсионное взаимодействие – электростатическое притяжение мгновенных микродиполей вещества.
Донорно-акцепторный механизм образования связи. Двухэлектронная связь образуется за счет свободной (вакантной) орбитали одного из атомов и неподеленной электронной пары другого атома по следующей схеме:

Индукционное взаимодействие – электростатическое притяжение постоянных и наведенных (индуцированных) диполей вещества.
Ионная связь – химическая связь, реализованная за счет образования и электростатического притяжения разноименно заряженных ионов.
Ковалентность - мера способности атома к образованию связи, количественным выражением которой является число двухэлектронных связей, образуемых им по обменному и донорно-акцепторному механизму.
Металлическая связь – химическая связь, обусловленная взаимодействием электронного газа, образованного валентными электронами, с остовом положительно заряженных ионов кристаллической решетки.
Обменный механизм образования связи. Связывающие электронные пары формируются из неспаренных электронов взаимодействующих атомов по следующей схеме:

Ориентационное взаимодействие – электростатическое притяжение постоянных диполей вещества.
Полярная связь – асимметричная ковалентная связь между атомами с разной электроотрицательностью.
Принцип метода МО-ЛКАО: волновая функция молекулярной орбитали конструируется как линейная комбинация волновых функций атомных орбиталей.
Связывающие, несвязывающие и разрыхляющие молекулярные орбитали. Связывающая МО имеет энергию меньше энергии исходных атомных орбиталей, разрыхляющая МО имеет энергию больше энергии исходных атомных орбиталей. Несвязываюшие МО – это АО, перешедшие в молекулу без изменения.
Сигма-, пи- и дельта-связь. Сигма-связь (s-связь): перекрывание валентных орбиталей происходит вдоль линии связи, т.е. линии, соединяющей ядра взаимодействующих атомов. Пи-связь (p-связь): перекрывание орбиталей происходит в направлении, перпендикулярном линии связи (боковое перекрывание). Дельта-связь (d-связь): перекрывающиеся орбитали расположены в двух параллельных плоскостях, перпендикулярных линии связи.
Электронная конфигурация молекулы - распределение электронов по молекулярным орбиталям.
Электроотрицательность - характеристика, определяющая способность атомов притягивать к себе электроны, участвующие в образовании химических связей.
Энергия связи - это энергия, которую необходимо затратить на ее разрушение.
Поиск по сайту: