 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Строение коллоидных частиц суспензоидов
Рассмотрим строение коллоидной частицы на примере коллоидного раствора сульфата бария, полученного методом химической конденсации при взаимодействии хлорида бария с сульфатом натрия, взятом в избытке:
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
избыток золь
При взаимодействии реагентов ионы Ва2+ и SO 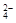 образуют мельчайшие кристаллики сульфата бария (агрегаты). Если концентрации реагентов велики, эти агрегаты быстро растут и выпадают в осадок. Однако при низких концентрациях и наличии избытка одного из реагентов в системе начинают протекать процессы адсорбции, препятствующие укрупнению кристаллов. Адсорбцией называется процесс самопроизвольного увеличения концентрации частиц на поверхности раздела фаз. Образовавшиеся агрегаты адсорбируют из раствора определенные ионы; установить, какой из ионов будет концентрироваться на поверхности агрегата, можно по правилу Фаянса-Паннета: на поверхности твердого тела в первую очередь адсорбируются ионы, входящие в его кристаллическую решетку или способные замещать какой-либо ион в этой решетке. Эти ионы называют потенциалопределяющими ионами. В рассматриваемом случае в растворе будут присутствовать ионы натрия и сульфат-ионы, образующиеся при диссоциации сульфата натрия
образуют мельчайшие кристаллики сульфата бария (агрегаты). Если концентрации реагентов велики, эти агрегаты быстро растут и выпадают в осадок. Однако при низких концентрациях и наличии избытка одного из реагентов в системе начинают протекать процессы адсорбции, препятствующие укрупнению кристаллов. Адсорбцией называется процесс самопроизвольного увеличения концентрации частиц на поверхности раздела фаз. Образовавшиеся агрегаты адсорбируют из раствора определенные ионы; установить, какой из ионов будет концентрироваться на поверхности агрегата, можно по правилу Фаянса-Паннета: на поверхности твердого тела в первую очередь адсорбируются ионы, входящие в его кристаллическую решетку или способные замещать какой-либо ион в этой решетке. Эти ионы называют потенциалопределяющими ионами. В рассматриваемом случае в растворе будут присутствовать ионы натрия и сульфат-ионы, образующиеся при диссоциации сульфата натрия
Na2SO4 = 2Na+ + SO 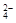
Очевидно, что на поверхности агрегатов будут адсорбироваться сульфат-ионы. Агрегат с адсорбированными потенциалопределяющими ионами образует ядро коллоидной частицы
[(BaSO4)m∙nSO 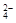 ]
]
где число формульных единиц в агрегате (m) представляет величину порядка нескольких тысяч, а n<<m. Наличие у ядер одноименного электрического заряда препятствует их дальнейшему укрупнению.
Несущее отрицательный заряд ядро притягивает из раствора ионы противоположного знака, называемые противоионами. В рассматриваемом случае в роли противоионов выступают катионы натрия. Концентрирование противоионов у поверхности ядра сопровождается, с одной стороны, понижением энергии системы, что благоприятствует процессу концентрирования противоионов, а с другой - повышением энтропии системы, что этому процессу препятствует. В результате 2n катионов натрия, необходимых для компенсации заряда ядра, образуют два слоя противоионов: адсорбционный, жестко связанный с поверхностью, и диффузный, противоионы которого обладают определенной подвижностью и с ядром жестко не связаны. Противоионы адсорбционного и диффузного слоя находятся в состоянии динамического равновесия. При изменении условий ионы могут переходить из адсорбционного слоя в диффузный и обратно. Ядро с адсорбционным слоем противоионов образует гранулу, которая является компактной частью коллоидной частицы. Гранула и диффузный слой противоионов образуют собственно коллоидную частицу или мицеллу. Если из 2n ионов натрия 2(n-x) входят в адсорбционный слой, а 2х - в диффузный, мицелла сульфата бария имеет следующцю формулу:
{[(BaSO4)m·nSO 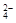 ]2(n-x)Na+}2x-2xNa+
]2(n-x)Na+}2x-2xNa+
│ гранула │
│ мицелла │
Таким образом, мицелла в целом электронейтральна, но гранула имеет заряд; именно этот заряд препятствует укрупнению коллоидных частиц и обеспечивает устойчивость золя. Схема строения коллоидной частицы сульфата бария, полученного при избытке сульфат-ионов, показана на рис. 51

Рис. 51. Строение коллоидной частицы BaSO4, полученной в избытке сульфата натрия:
1 – агрегат; 2 – слой потенциалопределяющих ионов; 3 – ядро; 4 – адсорбционный слой противоионов;
5 – гранула; 6 – диффузный слой противоионов; 7 – мицелла
Коллоидная частица пребывает в состоянии хаотического движения; в связи с этим гранула частицы непрерывно смещается относительно диффузного слоя противоионов, и на границе раздела гранула - диффузный слой противоионов возникает скачок потенциала, называемый электрокинетическим потенциалом коллоидной частицы. Наличие у гранулы электрического заряда вызывает ее направленное перемещение в электрическом поле. Это явление называется электрофорезом. Одновременно к другому электроду, заряд которого одноименен заряду гранулы, перемещаются противоионы, увлекая вместе с собой гидратирующий их растворитель (явление электроосмоса). В случае рассматриваемого золя сульфата бария коллоидные частицы будут перемещаться к аноду, а растворитель - к катоду.
Если получить золь сульфата бария при избытке хлорида бария, то в роли потенциалопределяющих ионов в соответствии с правилом Фаянса-Паннета выступят ионы бария, а в качестве противоионов - ионы хлора. В этом случае мицелла будет иметь следующее строение:
{[(BaSO4)m·nBa2+]2(n-x)Cl-}2x+2xCl-
Как уже отмечалось, коллоидные растворы, в отличие от истинных растворов, термодинамически нестабильны, однако они способны длительное время существовать без разделения на дисперсную фазу и дисперсионную среду. Можно выделить две составляющие устойчивости коллоидных растворов:
1. Кинетическая устойчивость. Характеризует способность коллоидных частицмёперн 7- не оседать из дисперсионной среды. Кинетическая устойчивость обусловлена броуновским движением частиц, препятствующим их оседанию. Чем меньше размеры частиц, тем выше кинетическая устойчивость золя.
2. Агрегативная устойчивость. Определяет способность золя сохранять степень дисперсности, т.е. способность системы длительно существовать без укрупнения частиц дисперсной фазы. Агрегативная устойчивость зависит от двух факторов. Первым из них является электростатический фактор, обусловленный наличием электрического заряда у гранул, который препятствует их сближению и укрупнению. Вторым фактором является гидратация коллоидных частиц. Если частицы окружены плотной гидратной оболочкой, то это препятствует их "склеиванию" и укрупнению. Для суспензоидов этот фактор обычно особого значения не имеет, так как суспензоиды (лиофобные коллоиды) обычно гидратируются очень слабо. Однако для ассоциативных коллоидов и растворов высокомолекулярных соединений (лиофильные коллоиды) роль этого фактора очень велика.
При изменении условий устойчивость коллоидного раствора может быть нарушена, следствием чего является разрушение системы. Так, устойчивость коллоидного раствора понижается, если в него вводить тот или иной электролит. При добавлении электролита возрастает концентрация противоионов в жидкой фазе, в результате чего противоионы начинают переходить из диффузного слоя в адсорбционный. Заряд гранулы при этом понижается, а вероятность столкновения частиц с последующим их склеиванием возрастает. Процесс укрупнения частиц дисперсной фазы называется процессом коагуляции. Коагулирующее действие электролита характеризуется порогом коагуляции - минимальной концентрацией коагулятора, достаточной для разрушения коллоидного раствора. Порог коагуляции очень сильно зависит от заряда коагулирующего иона. Для одно-, двух- и трехзарядных ионов пороги коагуляции относятся как 1:0,016:0,0014.
Укрупнившиеся частицы дисперсной фазы утрачивают кинетическую устойчивость и оседают на дно сосуда. Этот процесс называется седиментацией. Процессы коагуляции и седиментации взаимосвязаны: коагуляция подготавливает седиментацию, седиментация завершает коагуляцию.
Коагуляции коллоидных растворов способствует также повышение температуры, так как такое воздействие смещает адсорбционное равновесие в сторону десорбции.
Процесс коагуляции в ряде случаев обратим. Обратный переход выпавшего в результате коагуляции и седиментации осадка в коллоидный раствор называется пептизацией. Пептизация может быть вызвана введением в раствор избытка потенциалопределяющих ионов. Например, мицелла золя гидроксида железа(III), образованная при избытке хлорида железа имеет следующее строение:
{[(Fe(OH)3)m∙nFe3+]3(n-x)Cl-}3x+3xCl-
Вызвать коагуляцию этого золя можно добавлением сульфата аммония (коагулятор - двухзарядный сульфат-ион). Однако если выпавший в результате коагуляции и седиментации осадок гидроксида железа(III) отфильтровать и обработать на фильтре концентрированным раствором FeCl3, ионы Fe3+ начнут адсорбироваться на осадке, оказывая на него расклинивающее действие. В результате гидроксид железа вновь образует коллоидный раствор.
Коагуляция коллоидного раствора не всегда завершается седиментацией. В некоторых случаях, когда мицеллы коллоида имеют вытянутую форму, коллоидные частицы соединяются при коагуляции лишь определенными участками, образуя трехмерную структуру, в полостях которой удерживается дисперсионная среда. В результате весь коллоидный раствор превращается в псевдотвердую субстанцию, называемую гелем или студнем. Примером неорганического геля может служить гель кремниевой кислоты, образующийся при добавлении к раствору силиката натрия эквивалентного количества хлороводородной кислоты
Na2SiO3 + 2HCl = Н2SiO3 + 2NaCl
гель
К образованию гелей склонны многие органические полимеры, например, желатин и агар-агар.
ТЕМАТИЧЕСКИЙ ГЛОССАРИЙ
Поиск по сайту: