 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Теория растворов
Активность и коэффициент активности. Активность – это эффективная концентрация, с которой частица проявляет себя в растворе. Рассчитывается по уравнению а = f×С, где – f – коэффициент активности.
Водородный показатель – отрицательный десятичный логарифм концентрации катионов водорода, pH = -lg[H+].
Гидролиз солей – обменное взаимодействие ионов соли с водой.
Диаграмма состояния отражает зависимость между температурой и давлением насыщенного пара вещества.
Закон Вант-Гоффа: осмотическое давление раствора равно давлению, которое оказывало бы растворенное вещество, находящееся в газообразном состоянии и занимающее объем, равный объему раствора.
Ионная сила раствора – полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат их заряда.
μ = 0,5ΣСizi2
Ионизация – образование ионов при взаимодействии молекул растворенного вещества с растворителем.
Ионное произведение воды – произведение концентраций катионов водорода и гидроксид-анионов в водных растворах: Kw = [H+][OH-] при 25 °С Кw = 1×10-14.
Константа ионизации – константа равновесия в растворе слабого электролита.
Константа кислотности и константа основности – константа равновесия, установившегося в растворе результате ионизации (диссоциации) кислоты или основания.
Константа устойчивости комплексного иона – константа равновесия, которое устанавливается в растворе при образовании комплексной частицы из центрального иона и лигандов.
Кислоты и основания Бренстеда-Лоури. Кислота Бренстеда – это донор протонов, основание Бренстеда – это акцептор протонов.
Кислоты и основания Льюиса. Кислота Льюиса – донор неподеленной электронной пары, основание Льюиса – акцептор неподеленной электронной пары.
Кислоты и основания в теории сольвосистем. Кислота - это вещество, отщепляющее в растворе тот же катион, что и диссоциирующий растворитель. Основание - это вещество, отщепляющее в растворе тот же анион, что и диссоциирующий растворитель.
Концентрация раствора – количественное соотношение между растворителем и растворенными веществами в растворе.
Коэффициент растворимости - масса растворенного вещества, образующего насыщенный раствор со 100 г растворителя.
Массовая доля - отношение массы растворенного вещества к массе раствора

Мольная доля - отношение количества данного компонента к суммарному количеству всех компонентов раствора
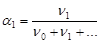
Моляльность - отношение количества растворенного вещества к массе растворителя, выраженной в кг
 ,
,
где m1 и m0 - массы растворенного вещества и растворителя, М1 - молярная масса растворенного вещества.
Молярность - отношение количества растворенного вещества к объему раствора
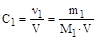 ,
,
где m1, M1 и ν1 - масса, молярная масса и количество растворенного вещества.
Нормальность - отношение количества эквивалента растворенного вещества к объему раствора
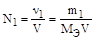 ,
,
где МЭ - эквивалентная масса растворенного вещества.
Осмос – односторонняя диффузия растворителя через полупроницаемую мембрану.
Осмотическое давление – разность давлений раствора и растворителя на полупроницаемую мембрану.
Правило фаз: С + Ф = К + 2, где С - число степеней свободы, Ф - число фаз, К - число компонентов.
Первый закон Рауля: относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного вещества:
 или
или 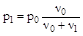 ,
,
где р0 и р1 - давление насыщенного пара над растворителем и раствором, ν0 и ν1 - количество растворителя и растворенного вещества.
Произведение растворимости – произведение концентраций ионов малорастворимого электролита в насыщенном растворе.
Растворы - это однородные (гомогенные системы), состоящие из двух и более компонентов.
Растворимость - способность вещества переходить в раствор. Количественной мерой растворимости является концентрация насыщенного раствора. Насыщенным называется раствор, находящийся в динамическом равновесии с избытком растворяемого вещества.
Степень диссоциации (ионизации) – отношение количества электролита, распавшегося на ионы, к общему его количеству в растворе.
Уравнение Дебая – Хюккеля:
 ,
,
где f – коэффициент активности, z – заряд иона, m - ионная сила раствора.
Электролитическая диссоциация – распад электролита на ионы под действием растворителя или высокой температуры при плавлении.
Энтальпия растворения – тепловой эффект растворения одного моля вещества в бесконечно большом объеме растворителя.
Поиск по сайту: