 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Общая характеристика коллоидных растворов и методы их получения
Если какую-либо фазу подвергнуть измельчению (диспергированию) и равномерно распределить в другой фазе, то полученная при этом система называется дисперсной; фаза, подвергнутая диспергированию, называется дисперсной фазой (ДФ), а фаза, в которой ДФ распределена, - дисперсионной средой (ДС).
По размерам частиц ДФ дисперсные системы подразделяются на два типа:
1. Грубодисперсные системы. Диаметр частиц ДФ превышает 10-5 см (100 нм). По агрегатному состоянию ДФ грубодисперсные системы подразделяют на суспензии (ДФ твердая) и эмульсии (ДФ жидкая). Примером суспензии может служить взмученная в воде глина, примером эмульсии - молоко. Грубодисперсные системы неустойчивы и при стоянии самопроизвольно разделяются на ДФ и ДС.
2. Тонкодисперсные (микрогетерегенные) системы или коллоидные растворы. Коллоидные растворы занимают промежуточное положение между грубодисперсными системами и истинными растворами, в случае которых растворенное вещество распадается на молекулы и ионы и перестает образовывать индивидуальную фазу. Выделение коллоидных растворов в отдельный класс химических объектов обусловлено двумя причинами.
а) Коллоидные растворы характеризуются чрезвычайно большой удельной поверхностью дисперсной фазы
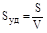 ,
,
где S - поверхность частиц, V - их объем.
Так, поверхность 1 см3 частиц с диаметром 10-6 см составляет 600 м2.
б) В микрогетерогенных системах значительная часть молекулярных или атомных частиц вещества находится на поверхности раздела фаз и обладает избыточной поверхностной энергией; очевидно, что в результате этого свойства вещества в глубине фазы и на ее поверхности не будут одинаковыми.
Фактически в коллоидных системах мы имеем дело с принципиально новым состояние вещества, которое является предметом изучения отдельной химической дисциплины - коллоидной химии. Коллоидная химия - это физическая химия дисперсных систем и поверхностных явлений.
Микрогетерогенные системы могут быть классифицированы по ряду признаков.
I. По агрегатному состоянию дисперсной фазы и дисперсионной среды. По этому признаку можно выделить 9 типов дисперсных систем:
| Тип | ДФ/ДС | Система |
| Т/Ж | Коллоидные растворы твердых веществ (золи) | |
| Ж/Ж | Эмульсии | |
| Г/Ж | Пены | |
| Т/Т | Сплавы, стекла, минералы | |
| Ж/Т | Студни (гели), капиллярные системы | |
| Г/Т | Минералы, пористые системы | |
| Т/Г | Аэрозоли | |
| Ж/Г | Аэрозоли | |
| Г/Г | Флуктуации плотности разряженных газов |
II. По силе взаимодействия между частицами дисперсной фазы различают:
а) свободнодисперсные системы (золи), частицы которых слабо взаимодействуют друг с другом;
б) связнодисперсные системы (гели), частицы которых сильно взаимодействуют друг с другом.
II. По природе частиц дисперсной фазы выделяют три группы коллоидных растворов:
1. Суспензоиды - коллоидные растворы, в которых дисперсная фаза сохраняет свою кристаллическую решетку. Коллоидные частицы в этом случае - это мельчайшие кристаллики ДФ. Суспензоиды образуют вещества, нерастворимые в данном растворителе. Примером их могут служить коллоидные растворы металлов, оксидов, малорастворимых гидроксидов и солей. Суспензоиды обычно не очень устойчивы и при изменении условий могут разрушаться. Частицы суспензоидов проходят через бумажные фильтры, но задерживаются полупроницаемыми мембранами. Максимальные концентрации суспензоидов малы (порядка 0,1 масс.%); частицы дисперсной фазы слабо гидратируются.
2. Ассоциативные или мицеллярные коллоиды, образованные поверхностно-активными веществами (ПАВ). Поверхностно-активными веществами называют вещества, способные накапливаться на поверхности раздела фаз, понижая поверхностное натяжение. Молекулы подобных веществ имеют легко гидратируемую (гидрофильную) функциональную группу и длинный негидратируемый (гидрофобный) радикал. Примером ПАВ могут служить натриевые или калиевые соли высших карбоновых кислот (мыла), гидрофильной группой которых является карбоксильная группа (рис. 50,а). При растворении в воде ионы карбоновых кислот стремятся "спрятать" углеводородные радикалы, образуя ассоциаты (мицеллы), в которых гидрофобные группы ориентированы внутрь частицы, а гидрофобные - наружу. Подобные ассоциаты могут быть двух типов: глобулярные мицеллы (рис. 50,б) и пластинчатые мицеллы (рис. 50,в). Мицеллярные коллоидные растворы могут образовываться самопроизвольно. Их устойчивость значительно выше, чем устойчивость суспензоидов.
а) 

б) в)
Рис. 50. Мициллярные коллоиды:
а) – молекула ПАВ;
б) – глобулярная мицелла;
в) – пластинчатая мицелла
3. Молекулярные коллоиды, являющиеся растворами высокомолекулярных соединений (белков, полимеров), молекулы которых имеют размеры коллоидных частиц. Фактически такие растворы являются истинными, но в связи с размерами частиц им присущи свойства коллоидных растворов. Растворы высокомолекулярных соединений обладают неограниченной устойчивостью. Если из такого раствора удалить растворитель, то выделившееся высокомолекулярное соединение можно снова перевести в состояние коллоидного раствора, добавив растворитель. Поэтому молекулярные коллоиды называют обратимыми.
Коллоидным растворам присущи некоторые специфические свойства. Так, характерным свойством коллоидных растворов является их способность к светорассеянию. Размеры коллоидных частиц близки к длине волн видимого света, поэтому свет при прохождении через коллоидный раствор рассеивается. В результате наблюдатель, глядя на раствор в направлении, перпендикулярном световым лучам, видит светящийся конус (эффект Фарадея-Тиндаля). Интенсивность рассеяния света обратно пропорциональна четвертой степени длины волны

В силу этого коллоидные системы наиболее сильно рассеивают лучи синей части спектра, а менее всего - красной. По этой причине конус Тиндаля имеет голубой цвет.
С малыми размерами коллоидных частиц связано также то, что они находятся в постоянном хаотическом движении (броуновское движение): в каждый момент времени равнодействующая столкновений коллоидной частицы с молекулами растворителя не равна нулю, в результате чего частица движется по ломаной траектории.
Поскольку коллоидные растворы занимают промежуточное положение между грубодисперсными системами и истинными растворами, их можно получать двумя путями: либо измельчением частиц ДФ до размеров коллоидных частиц (методы диспергирования), либо соединением отдельных атомов, ионов и молекул в коллоидную частицу (методы конденсации). Получая коллоидный раствор методом диспергирования, вещество, взятое обычно в виде суспензии, измельчают либо механически с помощью так называемых коллоидных мельниц, либо действием ультразвука. Методы конденсации более разнообразны. Различают физическую и химическую конденсацию. В случае физической конденсации для получения коллоидного раствора используют фазовые переходы. Так, например, коллоидный раствор натрия в бензоле можно получить быстрым охлаждением смеси паров натрия и бензола (метод конденсации из паров). Коллоидный раствор серы можно получить методом замены растворителя: насыщенный раствор серы в этаноле, являющийся истинным раствором, по каплям вводят в большое количество воды, в которой сера нерастворима и переходит в коллоидное состояние. Для получения коллоидных растворов методами химической конденсации используют разнообразные реакции образования малорастворимых соединений. Для того, чтобы при этом образовывался коллоидный раствор, а не осадок, реакцию проводят в очень разбавленных растворах, причем один из реагентов берется в избытке. Так, коллоидный раствор сульфата бария можно получить, добавив к 0,001М раствору сульфата натрия небольшие количества раствора хлорида бария. Коллоидный раствор серы получают при взаимодействии разбавленных растворов тиосульфата натрия и серной кислоты по уравнению
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S + H2O
золь
Для получения коллоидного раствора гидроксида железа(III) используют реакцию гидролиза: в кипящую воду по каплям добавляют раствор FeCl3.
FeCl3 + 3H2O = Fe(OH)3 + 3HCl
золь
Образующийся гидроксид железа(III) в осадок не выпадает, а переходит в коллоидное состояние.
При получении коллоидных растворов металлов часто используют электродуговой метод, сочетающий черты дисперсионного и конденсационного методов. Например, для получения коллоидного раствора золота в очень разбавленный раствор карбоната или гидроксида натрия погружают золотые электроды и подают на них разность потенциалов, достаточную для образования электрической дуги. При температуре электрической дуги металл электродов испаряется, переходя в атомарное состояние; пары металла, быстро охлаждаясь в растворе, конденсируются и образуют коллоидные частицы.
Полученные описанными методами коллоидные растворы обычно содержат растворимые примеси. Для удаления низкомолекулярных примесей используют ряд методов. Основным из них является метод диализа, основанный на использовании мембран, проницаемых для молекул и ионов, но непроницаемых для коллоидных частиц. Сосуд, стенки которого полупроницаемы, заполняют коллоидным раствором и погружают в проточную воду; за счет диффузии низкомолекулярных примесей в воду золь постепенно освобождается от этих примесей. Очистку золей от ионных примесей можно ускорить, если проводить диализ в электрическом поле (электродиализ). Другим методом очистки коллоидных растворов является ультрафильтрация: фильтрование золя под давлением через жесткие мелкопористые фильтры.
Поиск по сайту: