 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Метод валентных связей
Для описания химической связи в координационных соединениях используют различные теоретические подходы. В основе наиболее результативных из них лежат метод валентных связей, теория кристаллического поля и метод молекулярных орбиталей.
Применительно к координационным соединениям метод валентных связей утверждает, что в подобных соединениях обязательно реализуются связи, образованные по донорно-акцепторному механизму. В химии комплексных соединений такая связь называется координационной. Обычно в функции донора электронной пары при образовании координационной связи выступает лиганд, а в функции акцептора - центральный атом. В этом случае формирование связи происходит по схеме М: L, а результатом чаще всего является s-связь. Упрочнению связи способствует соответствующая гибридизация электронных орбиталей. Например, при образовании тетрафторобериллат-иона по уравнению
Be2+ + 4F- = [BeF4]2-
в роли акцептора выступает ион бериллия с электронной конфигурацией 1s22s02p0 (четыре вакантных орбитали валентного уровня). Эти орбитали подвергаются sp3-гибридизации. В качестве доноров в реакции (6-1) выступают фторид-анионы, имеющие четыре неподеленные пары. В результате образуется тетраэдрический ион [BeF4]2-:
sp3 - гибридизация

Координационная связь может формироваться также за счет неподеленной электронной пары центрального атома и вакантных орбиталей лиганда (обычно разрыхляющих) по следующей схеме:

Такая разновидность координационной связи называется p-дативной связью. Образование дативных связей упрочняет молекулу, так как способствует перетеканию электронной плотности с центрального атома на лиганд и повышению эффективного заряда центрального атома.
В зависимости от того, какие орбитали ЦА участвуют в гибридизации, последняя может быть внутренней или внешней.
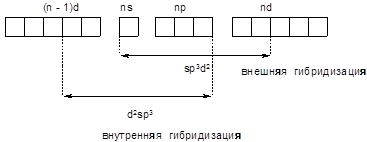
Рис. 34. Внутренняя и внешняя гибридизация
Из рассмотренных типов гибридизации s-, трех p- и двух d-орбиталей энергетически наиболее выгодной является внутренняя гибридизация, так как в этом случае в гибридизацию вовлекаются (n-1)d-орбитали, энергия которых ниже энергии nd-орбиталей. Поэтому у центральных атомов, содержащих в данной степени окисления не более трех электронов и, следовательно, не менее двух вакантных орбиталей на (n-1)d-орбиталях всегда наблюдается внутренняя гибридизация. Так, например, для центрального атома Cr3+, имеющего конфигурацию d3, всегда имеет место d2sp3-гибридизация.
Тип гибридизации центрального атома связан с координационным числом и определяет геометрическую форму комплекса. Наиболее часто встречающиеся формы координационного многогранника и соответствующие им типы гибридизации приведены в табл. 22.
Таблица 22
Формы координационного полиэдра и соответствующие им типы гибридизации
электронных орбиталей
| Форма координационного полиэдра | Тип гибридизации | КЧ | Примеры |
| Линейная | sp | [Ag(NH3)2]+, [CuCl2]- | |
| Тетраэдрическая | sp3 | [Zn(NH3)4]2+ | |
| d3s | [MnCl4]2- | ||
| Квадратная | dsp2 | [AuCl4]- | |
| Октаэдрическая | d2sp3 | [Fe(CN)6]3- | |
| sp3d2 | [Ni(NH3)6]2+ |
Метод валентных связей позволяет объяснить, почему данный комплекс имеет ту или иную форму, но не позволяет предсказывать геометрию координационного полиэдра. Однако в ряде случаев эта задача может быть решена методом Гиллеспи.
Используя метод валентных связей, можно объяснить, почему данный комплекс является парамагнитной или диамагнитной частицей. Так, например, комплекс [CoF6]3- является парамагнитным, а комплекс [Co(CN)6]3- - диамагнитным. Этот факт связан с тем, что во фторидном комплексе наблюдается внешняя гибридизация (sp3d2) и комплекс имеет 4 неспаренных электрона (высокоспиновый комплекс).
[CoF6]3-

В цианидном комплексе реализуется внутренняя гибридизация (d2sp3), сопровождающаяся спариванием электронов атома кобальта на 3d-орбиталях, в результате чего комплекс не содержит неспаренных электронов (низкоспиновый комплекс).
[Co(CN)6]3-

Однако следует отметить, что предсказать, будет ли данный комплекс парамагнитным или диамагнитным, метод валентных связей не может.
Поиск по сайту: