 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Окислительно-восстановительные реакции
Анод – электрод, на котором идет процесс окисления.
Восстановление – процесс понижения степени окисления, который можно рассматривать как присоединение атомом электронов.
Восстановитель – элемент, отдающий электроны и повышающий степень окисления.
Гальванический элемент - устройство, в которых энергия окислительно-восстановительной реакции преобразуется в энергию электрического тока.
Диспропорционирование и сопропорционирование – окислительно-восстановительные реакции, сопровождающаяся изменением степени окисления одного и того же элемента.
Закон Фарадея: масса выделившегося на электроде вещества пропорциональна количеству электричества, прошедшего через раствор или расплав.
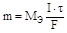
где m - масса продукта электролиза, I - сила тока, t - время пропускания тока, F – постоянная Фарадея (96485 Кл.моль-1), Мэ - эквивалентная масса вещества.
Катод – электрод, на котором идет процесс восстановления.
Направление окислительно-восстановительной реакции. В процессе ОВР из двух окисленных форм восстанавливается та, для которой электродный потенциал больше, а из двух восстановленных форм окисляется та, для которой электродный потенциал меньше.
Окисление – процесс повышения степени окисления, который можно рассматривать как потерю атомом электронов.
Окислитель – элемент, присоединяющий электроны и понижающий степень окисления.
Окислительно-восстановительные реакции – это реакции, сопровождающиеся изменением степеней окисления элементов.
Стандартный окислительно-восстановительный потенциал - разность потенциалов, возникающая на поверхности инертного электрода, погруженного в раствор, содержащий окисленную и восстановленную форму вещества в стандартных условиях.
Стандартный электродный потенциал - разность потенциалов, возникающая на поверхности металлического электрода, погруженного в раствор, содержащий ионы данного металла в стандартных условиях.
Степень окисления - формальный заряд, рассчитанный в предположении, что электроны, участвующие в образовании химических связей, полностью смещены к партнеру с большей электроотрицательностью, т.е. все химические связи рассматриваются как ионные.
Уравнение Нернста:  . При 298 К
. При 298 К 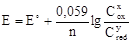
где R - универсальная газовая постоянная, Т - абсолютная температура, n - число электронов, соответствующее переходу окисленной формы в восстановленную, F – постоянная Фарадея (96485 Кл·моль-1), Cox и Cred - концентрации окисленной и восстановленной формы, x и y - коэффициенты в уравнении полуреакции, Е˚ - стандартный электродный потенциал.
Электролиз – совокупность окислительно-воссстановительных реакций, протекающих на электродах при пропускании электрического тока через раствор или расплав электролита.
Поиск по сайту: