 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекции 1-2. Современное атомно-молекулярное учение
Основные понятия химии, законы стехиометрии
Химическая атомистика (атомно-молекулярная теория) является исторически первой фундаментальной теоретической концепцией, положенной в основу современной химической науки. Формирование этой теории потребовало более сотни лет и связано с деятельностью таких выдающихся химиков, как М.В. Ломоносов, А.Л. Лавуазье, Дж. Дальтон, А. Авогадро, С. Канниццаро.
Современную атомно-молекулярную теорию можно изложить в виде ряда положений:
1. Химические вещества имеют дискретное (прерывистое) строение. Частицы вещества находятся в постоянном хаотическом тепловом движении.
2. Основной структурной единицей химического вещества является атом.
3. Атомы в химическом веществе связаны друг с другом, образуя молекулярные частицы или атомные агрегаты (надмолекулярные структуры).
4. Сложные вещества (или химические соединения) состоят из атомов разных элементов. Вещества простые состоят из атомов одного элемента и должны рассматриваться как гомоядерные химические соединения.
При формулировании основных положений атомно-молекулярной теории нам пришлось ввести несколько понятий, на которых необходимо остановиться более подробно, поскольку они являются основными в современной химии. Это понятия "атом" и "молекула", точнее атомные и молекулярные частицы.
Атомные частицы включают в себя собственно атом, атомные ионы, атомные радикалы и атомные ион-радикалы.
Атом - это наименьшая электронейтральная частица химического элемента, являющаяся носителем его химических свойств, и состоящая из положительно заряженного ядра и электронной оболочки.
Атомный ион - это атомная частица, обладающая электростатическим зарядом, но не имеющая неспаренных электронов, например, Cl- - хлорид-анион, Na+ - катион натрия.
Атомный радикал - электронейтральная атомная частица, содержащая неспаренные электроны. Например, атом водорода фактически представляет собой атомный радикал - Н ×.
Атомная частица, имеющая электростатический заряд и неспаренные электроны, называется атомным ион-радикалом. Примером такой частицы может служить катион Mn2+, содержащий пять неспаренных электронов на d-подуровне (3d5).
Одной из важнейших физических характеристик атома является его масса. Поскольку абсолютное значение массы атома ничтожно мало (масса атома водорода равна 1,67×10-27 кг), в химии используется относительная шкала масс, в которой за единицу выбрана 1/12 часть массы атома углерода изотопа-12. Относительная атомная масса - это отношение массы атома к 1/12 массы атома углерода изотопа 12С.
Следует отметить, что в периодической системе Д.И. Менделеева приведены среднеизотопические атомные массы элементов, которые в большинстве своем представлены несколькими изотопами, вносящими свой вклад в атомную массу элемента пропорционально своему содержанию в природе. Так, элемент хлор представлен двумя изотопами - 35Cl (75 мол.%) и 37Cl (25 мол.%). Среднеизотопическая масса элемента хлор составляет 35,453 а.е.м. (атомных единиц массы) (35×0,75 + 37×0,25).
Аналогично атомным частицам, молекулярные частицы включают в себя собственно молекулы, молекулярные ионы, молекулярные радикалы и ион-радикалы.
Молекулярная частица - это наименьшая устойчивая совокупность взаимосвязанных атомных частиц, являющаяся носителем химических свойств вещества. Молекула лишена электростатического заряда и не имеет неспаренных электронов.
Молекулярный ион - это молекулярная частица, обладающая электростатическим зарядом, но не имеющая неспаренных электронов, например, NO3- - нитрат-анион, NH4+ - катион аммония.
Молекулярный радикал – это электронейтральная молекулярная частица, содержащая неспаренные электроны. Большинство радикалов являются реакционными частицами с небольшим временем жизни (порядка 10-3 –10-5 с), хотя в настоящее время известны и довольно устойчивые радикалы. Так метильный радикал × СН3 является типичной малоустойчивой частицей. Однако, если атомы водорода в ней заменить на фенильные радикалы, то образуется стабильный молекулярный радикал трифенилметил

Молекулы с нечетным числом электронов, например NO или NO2, также могут рассматриваться как свободные радикалы с высокой устойчивостью.
Молекулярная частица, имеющая электростатический заряд и неспаренные электроны, называется молекулярным ион-радикалом. Примером такой частицы может служить катион радикал кислорода – ×О2+.
Важной характеристикой молекулы является ее относительная молекулярная масса. Относительная молекулярная масса (Мr) - это отношение среднеизотопической массы молекулы, вычисленной с учетом естественного природного содержания изотопов, к 1/12 массы атома углерода изотопа 12C.
Таким образом, мы выяснили, что мельчайшей структурной единицей любого химического вещества является атом, точнее атомная частица. В свою очередь в любом веществе, исключая инертные газы, атомы связаны друг с другом химическими связями. При этом возможно образование двух типов веществ:
· молекулярные соединения, у которых можно выделить мельчайшие носители химических свойств, обладающие устойчивой структурой;
· соединения надмолекулярной структуры, которые представляют собой атомные агрегаты, в которых атомные частицы связаны ковалентной, ионной или металлической связью.
Соответственно, вещества, имеющие надмолекулярную структуру, представляют собой атомные, ионные или металлические кристаллы. В свою очередь, молекулярные вещества образуют молекулярные или молекулярно-ионные кристаллы. Молекулярное строение имеют также вещества, находящиеся в обычных условиях в газообразном или жидком агрегатном состоянии.
Фактически, работая с конкретным химическим веществом, мы имеем дело не с отдельными атомами или молекулами, а с совокупностью очень большого числа частиц, уровни организации которых можно отобразить следующей схемой:

Для количественного описания больших массивов частиц, которыми являются макротела, было введено специальное понятие "количество вещества", как строго определенное число его структурных элементов. Единицей количества вещества является моль. Моль - это количество вещества (n), содержащее столько структурных или формульных единиц, сколько атомов содержится в 12 г углерода изотопа 12С. В настоящее время это число довольно точно измерено и составляет 6,022×1023 (число Авогадро, NA). В качестве структурных единиц могут выступать атомы, молекулы, ионы, химические связи и другие объекты микромира. Понятие "формульная единица" используется для веществ с надмолекулярной структурой и определяется как простейшее соотношение между составляющими его элементами (брутто-формула). В данном случае формульная единица берет на себя роль молекулы. Например, 1 моль хлорида кальция содержит 6,022×1023 формульных единиц - CaCl2.
Одной из важных характеристик вещества является его молярная масса (М, кг/моль, г/моль). Молярная масса - это масса одного моля вещества. Относительная молекулярная масса и молярная масса вещества численно совпадают, но имеют разную размерность, например, для воды Мr = 18 (относительная атомная и молекулярная массы величины безразмерные), М = 18 г/моль. Количество вещества и молярная масса связаны простым соотношением:

Большую роль в формировании химической атомистики сыграли основные стехиометрические законы, которые были сформулированы на рубеже XVII и XVIII столетий.
1. Закон сохранения массы (М.В. Ломоносов, 1748 г.).
Сумма масс продуктов реакции равна сумме масс веществ, вступивших во взаимодействие. В математическом виде этот закон выражается следующим уравнением:

Дополнением к данному закону является закон сохранения массы элемента (А. Лавуазье, 1789 г.). Согласно этому закону в процессе химической реакции масса каждого элемента остается постоянной.
Законы М.В. Ломоносова и А. Лавуазье нашли простое объяснение в рамках атомистической теории. Действительно, при любой реакции атомы химических элементов остаются неизменными и в неизменном количестве, что влечет за собой как постоянство массы каждого элемента в отдельности, так и системы веществ в целом.
Рассматриваемые законы имеют определяющее значение для химии, поскольку позволяют моделировать химические реакции уравнениями и выполнять на их основе количественные вычисления. Следует, однако, отметить, что закон сохранения массы не является абсолютно точным. Как следует из теории относительности (А. Эйнштейн, 1905 г.), любой процесс, протекающий с выделением энергии, сопровождается уменьшением массы системы в соответствии с уравнением:
DE = Dm×c2
где DЕ – выделившаяся энергия, Dm – изменение массы системы, с - скорость света в вакууме (3,0×108 м/с). В результате уравнение закона сохранения массы следует записывать в следующем виде:

Таким образом, экзотермические реакции сопровождаются уменьшением массы, а эндотермические – увеличением массы. В этом случае закон сохранение массы может быть сформулирован следующим образом: в изолированной системе сумма масс и приведенных энергий есть величина постоянная. Однако для химических реакций, тепловые эффекты которых измеряются сотнями кДж/моль, дефект массы составляет 10-8-10-9 г и не может быть зарегистрирован экспериментально.
2. Закон постоянства состава (Ж. Пруст, 1799-1804 гг.).
Индивидуальное химическое вещество молекулярного строения имеет постоянный качественный и количественный состав, не зависящий от способа его получения. Соединения, подчиняющиеся закону постоянства состава, называют дальтонидами. Дальтонидами являются все известные к настоящему времени органические соединения (около 30 миллионов) и часть (около 100 тыс.) неорганических веществ. Вещества, имеющие немолекулярное строение (бертолиды), не подчиняются данному закону и могут иметь переменный состав, зависящий от способа получения образца. К ним относятся большинство (около 500 тыс.) неорганических веществ. В основном это бинарные соединения d-элементов (оксиды, сульфиды, нитриды, карбиды и т.д.). Примером соединения переменного состава может служить оксид титана(III), состав которого варьирует в пределах от TiO1,46 до TiO1,56. Причиной переменного состава и иррациональности формул бертолидов являются изменения состава части элементарных ячеек кристалла (дефекты кристаллической структуры), не влекущие за собой резкого изменения свойств вещества. Для дальтонидов подобное явление невозможно, поскольку изменение состава молекулы ведет к образованию нового химического соединения.
3. Закон эквивалентов (И. Рихтер, Дж. Дальтон, 1792-1804 гг.).
Массы реагирующих веществ прямо пропорциональны их эквивалентным массам.
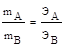 ,
,
где ЭА и ЭВ - эквивалентные массы реагирующих веществ.
Эквивалентной массой вещества называется молярная масса его эквивалента.
Эквивалент - это реальная или условная частица, отдающая или присоединяющая один катион водорода в реакциях кислотно-основного взаимодействия, один электрон в окислительно-восстановительных реакциях или взаимодействующая с одним эквивалентом любого другого вещества в реакциях обмена. Например, при взаимодействии металлического цинка с кислотой один атом цинка вытесняет два атома водорода, отдавая при этом два электрона:
Zn + 2H+ = Zn2+ + H2
Zn0 - 2e- = Zn2+
Следовательно, эквивалентом цинка является 1/2 его атома, т.е. 1/2 Zn (условная частица).
Число, показывающее, какая часть молекулы или формульной единицы вещества является его эквивалентом, называется фактором эквивалентности - fэ. Эквивалентная масса, или молярная масса эквивалента, определяется как произведение фактора эквивалентности на молярную массу:
Э = М·fэ
Например, в реакции нейтрализации серная кислота отдает два катиона водорода:
H2SO4 + 2KOH = K2SO4 + 2H2O
Соответственно, эквивалентом серной кислоты является 1/2 H2SO4, фактор эквивалентности равен 1/2, а эквивалентная масса составляет (1/2)×98 = 49 г/моль. Гидроксид калия связывает один катион водорода, поэтому его эквивалентом является формульная единица, фактор эквивалентности равен единице, а эквивалентная масса равна молярной массе, т.е. 56 г/моль.
Из рассмотренных примеров видно, что при расчете эквивалентной массы необходимо определить фактор эквивалентности. Для этого существует ряд правил:
1. Фактор эквивалентности кислоты или основания равен 1/n, где n - число задействованных в реакции катионов водорода или гидроксид-анионов.
2. Фактор эквивалентности соли равен частному от деления единицы на произведение валентности (v) катиона металла или кислотного остатка и их числа (n) в составе соли (стехиометрический индекс в формуле):
fэ = 
Например, для Al2(SO4)3 - fэ = 1/6
3. Фактор эквивалентности окислителя (восстановителя) равен частному от деления единицы на число присоединенных (отданных) им электронов.
Следует обратить внимание на то обстоятельство, что одно и то же соединение может иметь разный фактор эквивалентности в разных реакциях. Например, в реакциях кислотно-основного взаимодействия:
H3PO4 + KOH = KH2PO4 + H2O fэ(H3PO4) = 1
H3PO4 + 2KOH = K2HPO4 + 2H2O fэ(H3PO4) = 1/2
H3PO4 + 3KOH = K3PO4 + 3H2O fэ(H3PO4) = 1/3
или в окислительно-восстановительных реакциях:
KMn7+O4 + NaNO2 + H2SO4 ® Mn2+SO4 + NaNO3 + K2SO4 + H2O
MnO4- + 8H+ + 5e- ® Mn2+ + 4H2O fэ(KMnO4) = 1/5
KMn7+O4 + NaNO2 + H2O ® Mn4+O2 + NaNO3 + KOH
MnO4- + 2H2O + 3e- ® MnO2 + 4OH- fэ(KMnO4) = 1/3
4. Закон объемных отношений (Ж. Гей-Люссак, 1808 г.)
Изучая реакции между газообразными веществами, Гей-Люссак обнаружил общую закономерность, присущую данным процессам:
При постоянных температуре и давлении объемы вступивших в реакцию газов относятся друг к другу и к объемам газообразных продуктов реакции как небольшие целые числа.
Так, при взаимодействии водорода с хлором один объем водорода реагирует с одним объемом хлора, образуя два объема хлороводорода. При синтезе аммиака из простых веществ из трех объемов водорода и одного объема азота образуются два объема аммиака.
N2 + 3H2 = 2NH3
1V 3V 2V
Закон объемных отношений может быть объяснен на основе закона Авогадро.
5. Закон Авогадро (А. Авогадро, 1811 г.)
В 1811 году итальянский химик А. Авогадро показал, что закономерности реакций между газами могут быть объяснены, если принять следующую гипотезу. В равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул.
Закон Авогадро объясняется тем, что объем газа фактически представляет собой объем межмолекулярного пространства, тогда как собственным объемом молекул газа и силами притяжения между ними можно пренебречь. В результате объем газообразного вещества определяется лишь температурой и давлением и не зависит от природы, размеров и свойств молекул газа.
Из закона Авогадро вытекает несколько важных следствий:
1. При одинаковой температуре и давлении один моль любого газа занимает один и тот же объем. Действительно, поскольку число молекул в моле газа равно числу Авогадро, а одинаковое число молекул занимают одинаковый объем, молярный объем газа при постоянных условиях является величиной постоянной. При нормальных условиях (р0 = 101,325 кПа, Т0 = 273,15 К) молярный объем газа составляет 22,414 л.
2. Объемы прореагировавших газов относятся друг к другу и к объемам газообразных продуктов реакции как коэффициенты в уравнении реакции. Тем самым закон Авогадро объясняет закон объемных отношений.
3. В равных объемах различных газов при одинаковых условиях содержится равное количество вещества.
Поиск по сайту: