 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Энтропия. Второй и третий законы термодинамики
Термодинамические системы характеризуются различной степенью неупорядоченности. Так, например, водяной пар менее упорядочен, чем лед; система, состоящая из воды и хлорида натрия в виде отдельных фаз, более упорядочена, чем раствор, приготовленный из этих веществ. Для количественной характеристики неупорядоченности системы в термодинамике используют специальную термодинамическую функцию - энтропию (S). Чем больше энтропия системы, тем больше её неупорядоченность.
При переходе системы из одного состояния в другое энтропия может как повышаться, так и понижаться. Примерами процессов, протекающих с повышением энтропии, могут служить плавление, кипение, диффузия, растворение кристаллических веществ в жидкостях. Процессы, обратные рассмотренным, сопровождаются понижением энтропии. Для химических реакций энтропия увеличивается, если процесс сопровождается увеличением числа молекул газообразных соединений. В случае реакций, в которых участвуют только кристаллические вещества, энтропия меняется незначительно. Рассмотрим, как можно количественно охарактеризовать энтропию системы.
Состояние термодинамической системы можно задать двояко:
1) Указать значения макропараметров системы - давления, объема, температуры, количества вещества; состояние системы, заданное таким способом, называется макросостоянием.
2) Указать параметрыв всех частиц, образующих систему - координаты, импульсы и энергии; состояние системы, заданное микропараметрами частиц, называется микросостоянием. Очевидно, что каждому макросостоянию отвечает несколько (зачастую огромное число) микросостояний.
Число микросостояний, позволяющих реализовать то или иное макросостояние, называется термодинамической вероятностью данного состояния (W). Чем выше термодинамическая вероятность, тем чаще система будет находиться в этом состоянии.
Рассмотрим в качестве модельной системы, распределение четырех молекул газа по двум половинам сосуда, разделенным мысленными перегородками.
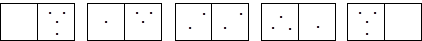
W = 1 W = 4 W = 6 W = 4 W = 1
Первое состояние можно реализовать только одним способом. Второе состояние можно реализовать четырьмя способами, меняя молекулу в левой части системы. При реализации третьего состояния возможны шесть перестановок молекул, поэтому вероятность данного состояния равна шести. Очевидно, что термодинамическая вероятность, а соответственно и энтропия состояния, отвечающего равномерному распределению молекул в системе максимальна.
Энтропия моля вещества связана с термодинамической вероятностью уравнением Больцмана
S = RlnW,
где R - универсальная газовая постоянная. Значение энтропии, равное 1 Дж/моль×К, называется энтропийной единицей (э.е.). Для одной частицы уравнение Больцмана имеет вид:
S = klnW,
где k - постоянная Больцмана
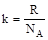 =1,38.10-23 Дж/К,
=1,38.10-23 Дж/К,
где NA - число Авогадро.
Как указывалось выше, то или иное состояние системы реализуется тем чаще, чем больше термодинамическая вероятность этого состояния. Отсюда можно заключить, что чем больше энтропия, тем больше вероятность перехода системы в состояние, отвечающее этой энтропии. Это заключение выражает суть второго закона термодинамики: изолированная система самопроизвольно изменяется в направлении состояния, обладающего максимальной термодинамической вероятностью и, следовательно, максимальной энтропией.
Часто используют и другую формулировку второго закона термодинамики:
Теплота не может самопроизвольно переходить от холодного тела к горячему.
Эти две формулировки взаимосвязаны и равноценны. Действительно, переход теплоты от холодного тела к горячему сопровождается сосредоточиванием в одной части системы быстрых ("горячих") молекул, а в другой - медленных ("холодных"). Упорядоченность системы при этом возрастает, а термодинамическая вероятность и энтропия понижаются. Согласно первой формулировке второго закона термодинамики такой процесс не может протекать самопроизвольно, если система не обменивается с другими системами энергией. Таким образом, процессы, идущие с понижением энтропии, в изолированной системе являются вынужденными.
Изменение энтропии системы при переходе из начального состояния в конечное
 ,
,
где W1 и W2 - термодинамические вероятности начального и конечного состояния системы.
На энтропию оказывают влияние следующие факторы:
1. Агрегатное состояние вещества. Фазовые переходы из кристаллического в жидкое, а затем в газообразное состояние сопровождаются повышением энтропии.
2. Сложность структуры частиц. Усложнение структуры влечет за собой увеличение энтропии. Так, например, для атомарного кислорода О, молекулярного кислорода О2 и озона О3 значения энтропии при стандартных условиях составляют 161, 205 и 239 Дж/моль×К. Это явление можно объяснить тем, что по мере усложнения структуры молекул для последних становятся возможными новые формы движения частиц, что сопровождается увеличением термодинамической вероятности состояния. Действительно, для атомарного кислорода частицы могут отличаться лишь поступательным движением, тогда как для молекулярного кислорода и озона возможно также вращательное и колебательное движение. При этом для угловых молекул озона набор разрешенных колебательных и вращательных движений больше, чем для линейной молекулы кислорода.
3. Температура. Повышение температуры приводит к возрастанию энтропии в связи с увеличением средней скорости движения молекул вещества. Если в температурном интервале Т1 ≤ Т ≤ Т2 не наблюдается фазовых переходов, изменение энтропии системы подчиняется уравнению
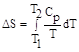 ,
,
где Ср - молярная теплоемкость вещества. Для случая, когда Ср - величина постоянная
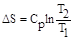
Как следует из полученного уравнения, с повышением температуры энтропия увеличивается.
Если температура системы постоянна, а процесс является равновесным, изменение энтропии связано с тепловым эффектом процесса (ΔН) следующим уравнением
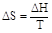
Например, для фазовых переходов, являющихся равновесными изотермическими процессами,
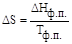
где ΔНф.п. и Тф.п. тепловой эффект и температура фазового перехода. Если процесс не является равновесным, то
 >
> 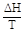
4. Давление. С увеличением давления энтропия понижается, но незначительно, особенно в конденсированных (твердых и жидких) системах. При повышении давления средние расстояния между частицами уменьшаются, взаимодействие между ними усиливается, и система становится более упорядоченной.
В отличие от всех остальных термодинамических функций для энтропии могут быть определены абсолютные ее значения, а не только изменение при переходе из одного состояния в другое. Пусть какое-либо вещество находится при температуре абсолютного нуля. В такой системе движение частиц вещества прекращается, и каждая частица имеет определенные, не изменяющиеся координаты. Подобному макросостоянию отвечает одно единственное микросостояние, а термодинамическая вероятность состояния равна единице, откуда
S0 = RTln1 = 0
Рассмотренное явление позволяет сформулировать третий закон термодинамики: при температуре абсолютного нуля энтропия идеального кристалла равна нулю.
Для реальных кристаллов энтропия при температуре 0 К может несколько отличаться от нуля. Это явление можно объяснить наличием в таких кристаллах дефектов кристаллической решетки. Включения (атомы, оказавшиеся в междоузлиях кристаллической решетки) и вакансии (незанятые места в кристаллической решетке) повышают неупорядоченность структуры и, следовательно, энтропию системы. Однако и в бездефектных кристаллах энтропия при Т = 0 К может быть выше нуля. Например, для кристаллического оксида углерода(II) S0 = 4,7 э.е. Отличие S0 от нуля в данном случае можно объяснить тем, что молекулы СО в кристалле могут сближаться как одинаковыми атомами (...СО…ОС…СО...), так и различными атомами (...СО…СО…СО...). В результате термодинамическая вероятность состояния становится равной двум, откуда
S0 = Rln2 = 5,7 Дж/моль.К,
что достаточно близко к наблюдаемой величине.
Поскольку энтропия является функцией состояния, изменение энтропии при протекании химической реакции
aA + bB = dD + eE
может быть вычислено по уравнению
ΔS = [dS(D) + eS(E)] - [aS(A) + bS(B)]
или в общем виде
ΔS = ΣniS(пр) - ΣmjS(реаг)
В химической практике широко используют значения энтропии простых и сложных веществ, отнесенные к стандартным условиям. Эти величины называются стандартными энтропиями (Δ 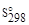 ); они приводятся в справочниках термодинамических свойств и используются при разнообразных термодинамических расчетах.
); они приводятся в справочниках термодинамических свойств и используются при разнообразных термодинамических расчетах.
В качестве примера рассчитаем изменение энтропии, отвечающее синтезу карбоната кальция и силиката кальция из оксидов:
1) СаО(к) + СО2(г) = СаСО3(к)
Δ 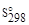 =
= 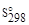 (СаСО3) - [
(СаСО3) - [ 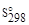 (CаО) +
(CаО) + 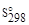 (СО2)] =
(СО2)] =
= 91,7 - (38,1 + 213,7) = -160,1 Дж/моль × К
2) СаО(к) + SiO2(к) = СаSiO3(к)
Δ 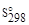 =
= 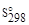 (CaSiO3) - [
(CaSiO3) - [ 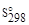 (CaO) +
(CaO) + 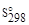 (SiO2)] =
(SiO2)] =
= 81,0 - (38,1 + 41,2) = 1,7 Дж/моль×К
Как и следовало ожидать, реакция образования карбоната кальция, при которой имеет место связывание газообразного вещества (СО2), сопровождается существенным уменьшением энтропии системы, а при синтезе силиката кальция из кристаллических оксидов энтропия почти не изменяется.
Поиск по сайту: