 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Изомерия координационных соединений
Под изомерией понимается соответствие одной молекулярной формуле нескольких индивидуальных химических соединений, называемых изомерами. Изомеры имеют одинаковую молекулярную массу, одинаковый качественный и количественный состав, но разное пространственное строение и, в силу этого, разные свойства. Для координационных соединений можно выделить около десяти видов изомерии. Остановимся на важнейших из них.
1. Ионизационная изомерия. Ионизационные изомеры отличаются распределением анионов между внутренней и внешней сферой координационного соединения. Она присуща катионным комплексам с различными лигандами во внутренней (координационной) сфере. Так, формуле CoSO4Br×5NH3 соответствуют два соединения. Одно из них - вещество фиолетового цвета, образующее BaSO4 при взаимодействии с BaCl2 и не реагирующее с нитратом серебра. Второе соединение имеет красную окраску, не взаимодействует с BaCl2 и дает осадок бромида серебра, реагируя с AgNO3.Эти изомеры отличаются распределением бромид- и сульфат-ионов между внутренней и внешней сферами и соответственно по-разному диссоциируют при растворении:
[Co(NH3)5Br]SO4 ® [Co(NH3)5Br]2+ + 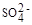
фиолетовый
[Co(NH3)5SO4]Br ® [Co(NH3)5SO4]+ + Br-
красный
2. Координационная изомерия. Этот вид изомерии присущ катионно-анионным комплексам. Изомеры отличаются различным распределением лигандов между комплексом-катионом и комплексом-анионом. Так, формуле CuPtCl4×4NH3 соответствуют два изомера: [Pt(NH3)4][CuCl4] и [Cu(NH3)4][PtCl4]; первое из этих соединений имеет зеленую окраску, второе - фиолетовую. Другим примером координационных соединений могут служить [Cr(NH3)6][Co(CN)6] и [Co(NH3)6][Cr(CN)6].
3. Изомерия связей (солевая изомерия). Изомеры отличаются тем, что одни и те же лиганды координируются через разные атомы (амбидентатные лиганды). К амбидентатным лигандам можно отнести ион  , способный координироваться как через атом азота, так и через атом кислорода. Примером солевых изомеров являются, например, [Co(NH3)5ONO]Cl2 (координация нитрит-иона происходит через атом кислорода) и [Co(NH3)5NO2]Cl2 (координация происходит через атом азота). Первое из этих соединений красное, второе - желтое.
, способный координироваться как через атом азота, так и через атом кислорода. Примером солевых изомеров являются, например, [Co(NH3)5ONO]Cl2 (координация нитрит-иона происходит через атом кислорода) и [Co(NH3)5NO2]Cl2 (координация происходит через атом азота). Первое из этих соединений красное, второе - желтое.
4. Сольватная (гидратная) изомерия. Этот тип изомерии обусловлен различным распределением молекул растворителя между внутренней и внешней сферами. Например, гексагидрат хлорида хрома(III) образует три гидратных изомера - фиолетовый [Cr(H2O)6]Cl3, светло-зеленый [Cr(H2O)5Cl]Cl2×H2O и темно-зеленый [Cr(H2O)4Cl2]Cl×2H2O.
5. Геометрическая изомерия. Изомеры отличаются различным взаимным расположением лигандов во внутренней (координационной) сфере. Наиболее простым видом геометрической изомерии является цис-транс изомерия, присущая, в частности, квадратным комплексам типа [МА2В2]. Комплексы, в которых одинаковые лиганды расположены на одной стороне квадрата, называют цис-изомерами (от лат. cis - "вместе"). Комплексы, в которых одинаковые лиганды располагаются на одной из диагоналей квадрата, называют транс-изомерами (от лат. trans - "напротив"). Например, дихлородиамминплатина образует два изомера:

Эти изомеры отличаются по цвету, растворимости и другим свойствам. Цис-транс изомерия наблюдается и для октаэдрических комплексов [МА2В4]. Примером могут служить изомеры комплекса [Co(NH3)4(NO2)2]+:

оранжевый желтый
Существуют и другие виды геометрической изомерии. Так, октаэдрические комплексы типа [МА3В3] образуют гран-изомеры (одинаковые лиганды располагаются на одной грани) и ос-изомеры (два одинаковых лиганда расположены на одной диагонали). Такие изомеры возможны для комплекса [Pt(NH3)3Cl3]+:

гран-изомер ос-изомер
(граневой или (осевой или
реберный) меридианальный)
6. Зеркальная изомерия. Изомеры соотносятся как предмет и его зеркальное отражение. Такие изомеры не могут быть совмещены при наложении одной формы на другую подобно правой и левой руке. Подобные молекулы называют хиральными (от греческого cheir - рука). Так, цис-изомер [Co(en)2(NH3)Cl]- cуществует в виде двух оптических изомеров


Поиск по сайту: