 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Гальванический элементы. Электролиз
Рассмотрим процессы, которые будут наблюдаться, если металлическую пластинку (электрод) опустить в воду. Поскольку все вещества в какой-то мере растворимы, в такой системе начнет протекать процесс перехода в раствор катионов металла с их последующей гидратацией. Освобождающиеся при этом электроны будут оставаться на электроде, сообщая ему отрицательный заряд. Отрицательно заряженный электрод будет притягивать катионы металла из раствора, в результате чего в системе установится равновесие
M  Mn+ + ne-,
Mn+ + ne-,
при котором электрод будет иметь отрицательный заряд, а прилегающий к нему слой раствора - положительный. Приведенное выше уравнение описывает полуреакцию, для которой окисленной формой являются катионы Mn+, а восстановленной формой - атомы металла М.
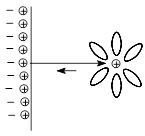
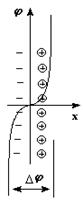
Если в рассматриваемую систему ввести соль, отщепляющую при диссоциации катионы Mn+, равновесие сместится в сторону обратной реакции; при достаточно высоком значении концентрации Mn+ становится возможным осаждение ионов металла на электроде, который при этом приобретет положительный заряд, тогда как прилегающий к поверхности электрода слой раствора, содержащий избыток анионов, будет заряжен отрицательно. Знак заряда электрода в конечном итоге будет определяться химической активностью металла, способствующей появлению отрицательного заряда, и концентрацией катиона металла в растворе, увеличение которой способствует появлению положительного заряда. Однако в любом случае в такой системе формируется двойной электрический слой и возникает скачок потенциала на границе раздела электрод – раствор (рис. 47).
| 
| 
| 
|
Рис. 47. Механизмы возникновения разности потенциалов на поверхности раздела металлический электрод – раствор соли металла
Скачок потенциала на границе раздела электрод - раствор называется электродным потенциалом.
В рассмотренном нами примере металл электрода подвергался химическим изменениям. Это условие не является обязательным для возникновения электродного потенциала. Если какой-либо инертный электрод (графитовый или платиновый) погрузить в раствор, содержащий окисленную и восстановленную формы (ОФ и ВФ) какой-то полуреакции, то на границе раздела электрод - раствор также возникнет скачок потенциала. Возникновение электродного потенциала в этом случае будет определяться протеканием полуреакции
ОФ + ne-  ВФ
ВФ
Поскольку обмен электронами идет через поверхность электрода, который в данном случае играет роль посредника, смещение равновесия в сторону прямой реакции будет способствовать появлению на электроде положительного заряда, а в сторону обратной реакции - отрицательного. Электрод при этом не будет изменяться химически; он будет лишь служить источником или приемником электронов, присоединяемых или отдаваемых частицами. Таким образом, любая окислительно-восстановительная реакция может быть охарактеризована определенным значением окислительно-восстановительного потенциала – разности потенциалов, возникающей на поверхности инертного электрода, погруженного в раствор, содержащий окисленную и восстановленную форму вещества.
Значение электродного потенциала зависит от природы и концентрации окисленной и восстановленной форм, а также от температуры. Эта зависимость выражается уравнением Нернста

где R - универсальная газовая постоянная, Т - абсолютная температура, n - число электронов, соответствующее переходу окисленной формы в восстановленную, F - число Фарадея (96485 Кл·моль-1), Cox и Cred - концентрации окисленной и восстановленной формы, x и y - коэффициенты в уравнении полуреакции, Е˚ - электродный потенциал, отнесенный к стандартным условиям (р = 101,326 кПа, Т = 298 К, Cox = Cred =1 моль/л). Величины Е˚ называют стандартными электродными потенциалами.
При температруе 298 К уравнение Нернста легко преобразуется к более простому виду:
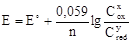
Абсолютные значения электродных потенциалов измерить невозможно: использование любых измерительных приборов в этом случае привело бы к появлению контактных разностей потенциалов. Однако можно определить относительные значения электродных потенциалов, сравнивая измеряемый потенциал с другим, принятым за эталон. В качестве такого эталонного потенциала используют стандартный потенциал водородного электрода. Водородный электрод представляет собой платиновую пластинку, покрытую слоем пористой платины (платиновая чернь) и погруженную в раствор серной кислоты с активностью катионов водорода, равной 1 моль/л, при температуре 298 К. Платиновая пластинка насыщается водородом под давлением, равным 101,326 кПа (рис. 48). Абсорбированный платиной водород является более активным компонентом, чем платина, и электрод ведет себя так, как если бы он бы выполнен из водорода. В результате в системе возникает электродный потенциал за счет полуреакции
Н2  2Н
2Н  2Н+ + 2е-
2Н+ + 2е-
Этот потенциал условно принимают равным нулю. Если окисленная форма той или иной полуреакции является более активным окислителем, чем катион водорода, значение электродного потенциала этой полуреакции будет величиной положительной, в противном случае - отрицательной. Величины стандартных электродных потенциалов приводят в справочных таблицах.
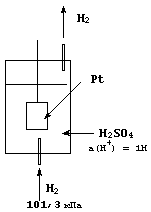
Рис. 48. Схема строения водородного электрода
Уравнение Нернста позволяет рассчитывать значения электродных потенциалов при различных условиях. Пусть, например, требуется определить электродный потенциал полуреакции
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O,
если температура равна 320 К, а концентрации MnO4-, Mn2+ и Н+ равны соответственно 0,800, 0,0050 и 2,00 моль/л; значение Е˚ для этой полуреакции равно 1,51 В. Соответственно
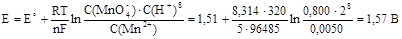
Поскольку электродный потенциал связан с изменением свободной энергии Гиббса соотношением
ΔG˚ = -nFE˚
электродные потенциалы могут быть использованы для определения направления окислительно-восстановительных процессов.
Пусть окислительно-восстановительной реакции соответствуют полуреакции
X(1) + n1e- = Y(1); ΔG1 = -n1FE1,
X(2) + n2e- = Y(2); ΔG2 = -n2FE2
Cовершенно очевидно, что одна из этих полуреакций должна протекать слева направо (процесс восстановления, сопровождающийся присоединением электронов), а другая - справа налево (процесс окисления, при котором электроны теряются). Изменение энергии Гиббса для рассматриваемой реакции будет определяться разностью электродных потенциалов полуреакций
ΔG = aΔG2 - bΔG1 = -nF(E2 - E1)
где a и b - множители, уравнивающие число отданных и присоединенных в процессе реакции электронов (n = an1 = bn2). Чтобы реакция протекала самопроизвольно величина ΔG должна быть отрицательной, а это будет иметь место тогда, когда Е2 > Е1. Таким образом, в процессе ОВР из двух окисленных форм восстанавливается та, для которой электродный потенциал больше, а из двух восстановленных форм окисляется та, для которой электродный потенциал меньше. Если реакция протекает при стандартных условиях, то
ΔG˚ = -nF 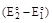
и для определения ее направления достаточно сравнить электродные потенциалы полуреакций.
Пусть, например, необходимо определить направления реакции
MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
при стандартных условиях. Запишем уравнения перехода двух окисленных форм в восстановленные и по справочным таблицам найдем соответствующие значения электродных потенциалов:
Fe3+ + 1e- = Fe2+ │5; E  = 0,77 B
= 0,77 B
MnO4- + 8H+ +5e- = Mn2+ +5Fe2+ +4H2O │1; E  = 1,51 B
= 1,51 B
Поскольку Е  > E
> E  , вторая полуреакция будет протекать слева направо, а первая полуреакция - справа налево. Таким образом, процесс будет протекать в направлении прямой реакции.
, вторая полуреакция будет протекать слева направо, а первая полуреакция - справа налево. Таким образом, процесс будет протекать в направлении прямой реакции.
Используя значения электродных потенциалов, можно рассчитать константу равновесия ОВР. Решим эту задачу для вышеприведенной реакции. Уравнения электродных потенциалов, обеспечивающих равновесие, примут вид:
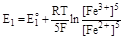 ,
,
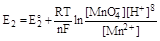
(концентрацию воды можно считать постоянной). Поскольку система находится в состоянии равновесия, то для нее ΔG, а, следовательно, и Е2 - Е1, равно нулю, откуда
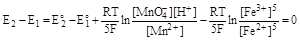
Следовательно
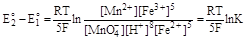
где К - константа равновесия. Решая уравнение относительно К, получаем:

Данная реакция, таким образом, является практически необратимой.
Окислительно-восстановительные реакции, как уже указывалось, сопровождаются переносом электронов от восстановителя к окислителю. Если разделить процессы окисления и восстановления в пространстве, можно получить направленный поток электронов, т.е. электрический ток. Устройства, в которых химическая энергия окислительно-восстановительной реакции преобразуется в энергию электрического тока, называются химическими источниками тока или гальваническими элементами.
В простейшем случае гальванический элемент состоит из двух полуэлементов - сосудов, заполненных растворами соответствующих солей, в которые погружены электроды. Полуэлементы соединены U-образной трубкой (сифоном), заполненной раствором электролита, или полупроницаемой мембраной, что дает возможность ионам переходить из одного полуэлемента в другой. Если электроды не соединены внешним проводником, то полуэлементы находятся в состоянии равновесия, обеспечиваемым определенным зарядом на электродах. Если же цепь замкнуть, равновесие нарушается, так как электроны начнут переходить с электрода, имеющего меньший электродный потенциал, на электрод с большим электродным потенциалом. В результате в системе начнет протекать окислительно-восстановительная реакция, причем на электроде с большим значением потенциала будет идти процесс восстановления, а на электроде с меньшим значением потенциала - процесс окисления. Электрод, на котором протекает реакция восстановления, называется катодом; электрод, на котором протекает реакция окисления, называется анодом.
В качестве примера рассмотрим элемент Даниэля-Якоби, который состоит из медного и цинкового электродов, погруженных в растворы сульфатов этих металлов (рис. 49).
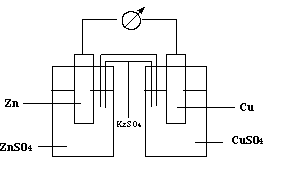
Рис. 49. Схема строения медно-цинкового гальванического элемента
В этом элементе окисленными формами являются катионы Zn2+ и Cu2+, восстановленными формами - цинк и медь. Уравнения полуреакций для системы имеют вид:
Zn2+ + 2e- = Zn0; E  = -0,76 B
= -0,76 B
Cu2+ + 2e- = Cu0; E  = 0,34 B
= 0,34 B
Поскольку Е  > E
> E  , вторая полуреакция будет протекать справа налево, а первая полуреакция - слева направо, т.е. в системе будет протекать реакция
, вторая полуреакция будет протекать справа налево, а первая полуреакция - слева направо, т.е. в системе будет протекать реакция
Zn + Cu2+ = Zn2+ + Cu
Процесс будет идти до тех пор, пока не растворится цинковый электрод или не восстановятся все ионы меди. В случае медно-цинкового элемента катодом является медный электрод (на нем ионы Cu2+ восстанавливаются до металлической меди), а анодом - цинковый электрод (на нем атомы цинка окисляются до ионов Zn2+). Электродвижущая сила элемента равна разности электродных потенциалов катода и анода, т.е.
ΔЕ = Екатода - Е анода
При стандартных условиях
ΔЕ = 0,34 - (-076) = 1,10 В
Для записи схемы гальванических элементов используют приведенную ниже форму:
Анод │ Анодный раствор ││ Катодный раствор │ Катод
Для анодного и катодного растворов указывают концентрации соответствующих ионов в момент начала работы гальванического элемента. Так, элементу Даниэля-Якоби с концентрациями CuSO4 и ZnSO4, равными 0,01 моль/л, отвечает схема:
Zn │ Zn2+ (0,01 M) ││ Cu2+ (0,01 M)│ Cu
Путем измерения ЭДС гальванических элементов определяют стандартные электродные потенциалы тех или иных полуреакций. Пусть, например, необходимо установить Е˚ полуреакции
Fe3+ + 1e- = Fe2+
Для этого достаточно собрать гальванический элемент
Pt│H2(г) (101,3 кПа), H+ (1M)││Fe3+ (1M), Fe2+ (1M) │Pt
и измерить его ЭДС. Последняя равна 0,77 В, откуда
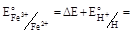 0,77 + 0 = +0,77 В
0,77 + 0 = +0,77 В 
Поиск по сайту: