 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекция 10. Механизм и кинетика гетерогенных реакций
Общие положения. Большинство металлургических реакций гетерогенны, т. е. взаимодействуют вещества, находящиеся в различных фазах. Гетерогенные процессы отличают многостадийность и сложность. Процесс состоит как минимум из трех стадий: 1) переноса реагирующих веществ к межфазной границе — реакционной зоне, 2) собственно химического акта взаимодействия и 3) отвода продуктов реакции из реакционной зоны. Каждый этап, в свою очередь, может состоять из ряда стадий. Перенос реакционного газа из общего турбулентного газового потока к границе ламинарного слоя осуществляется за счёт конвективной диффузии (рисунок 1), и можно принять, что концентрация газа на внешней границе ламинарного слоя в установившемся режиме сравняется с концентрацией реакционного газа в потоке  . На границе раздела неподвижного слоя и твёрдой фазы концентрация газа
. На границе раздела неподвижного слоя и твёрдой фазы концентрация газа  . В стационарном режиме различие в концентрациях реагирующих веществ не зависит от времени, т. е. в каждой точке различных фаз концентрация в ходе процесса сохранит постоянную величину. Согласно первому закону Фика поток вещества через воображаемое сечение, перпендикулярное направлению диффузии, пропорционален значению градиента концентраций в этом направлении.
. В стационарном режиме различие в концентрациях реагирующих веществ не зависит от времени, т. е. в каждой точке различных фаз концентрация в ходе процесса сохранит постоянную величину. Согласно первому закону Фика поток вещества через воображаемое сечение, перпендикулярное направлению диффузии, пропорционален значению градиента концентраций в этом направлении.  , где: П - поток вещества, кг/ (м2·сек); D - коэффициент диффузии, м2/сек,
, где: П - поток вещества, кг/ (м2·сек); D - коэффициент диффузии, м2/сек,  градиент концентрации в направлении диффузии, кг/м3·м.
градиент концентрации в направлении диффузии, кг/м3·м.

| Поток частиц газа через неподвижный и ламинарный слои будет представлен выражением:  , где , где  - коэффициент диффузии в продукте реакции; - коэффициент диффузии в продукте реакции;  — концентрация на границе раздела твёрдых фаз; — концентрация на границе раздела твёрдых фаз;  - концентрация свинца на межфазной границе твёрдое - газ; - концентрация свинца на межфазной границе твёрдое - газ;  - коэффициент массопередачи через ламинарный и неподвижный слои - коэффициент внешней диффузии. - коэффициент массопередачи через ламинарный и неподвижный слои - коэффициент внешней диффузии.
|
| Рисунок 1 – Схема диффузии газа (С0РГ – концентрация газа в потоке; СхРГ – концентрация газа на поверхности твердой фазы) |
В процессе реагирования поверхность реагирующего вещества покрывается слоем продукта реакции. Поверхность реагирующей фазы может быть покрыта минералами пустой породы (рисунок 1).
Поток частиц реакционного газа, диффундирующего через твёрдый слой, определится выражением:  , где:
, где:  - концентрация реакционного газа на поверхности твёрдой фазы (при протекании процесса
- концентрация реакционного газа на поверхности твёрдой фазы (при протекании процесса  =0);
=0);  - коэффициент массопередачи через слой продукта реакции – коэффициент внутренней диффузии.
- коэффициент массопередачи через слой продукта реакции – коэффициент внутренней диффузии.
Величина общего потока определяется уравнением: 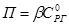 .
.
В условиях стационарности величины потоков через фазы равны: П = П1=П2, что связано с определением условия стационарности (в противном случае происходило бы накопление вещества в каком-либо участке системы). Тогда справедливо равенство:  , из которого можно определить концентрацию реакционного газа на границе газ - твёрдое:
, из которого можно определить концентрацию реакционного газа на границе газ - твёрдое: 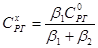 .
.
Подставив полученное значение  получим:
получим:  . Но учитывая, что
. Но учитывая, что 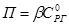 , а
, а 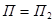 , получим уравнение:
, получим уравнение:  или
или  .
.
С учётом скорости кристаллохимических превращений общее сопротивление определится из уравнения: 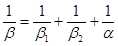 , где
, где  - кристаллохимическое сопротивление.
- кристаллохимическое сопротивление.
Величина, обратная коэффициенту массопередачи, называется коэффициентом сопротивления. В последовательных процессах общее сопротивление  равно сумме частных сопротивлений. Если один из коэффициентов сопротивления системы значительно больше других, то именно им и определяется общая скорость процесса. Следовательно, если гетерогенный процесс состоит из ряда последовательных стадий, то общая скорость процесса лимитируется скоростью самой медленной стадии.
равно сумме частных сопротивлений. Если один из коэффициентов сопротивления системы значительно больше других, то именно им и определяется общая скорость процесса. Следовательно, если гетерогенный процесс состоит из ряда последовательных стадий, то общая скорость процесса лимитируется скоростью самой медленной стадии.
В процессах с параллельным течением отдельных стадий общий коэффициент массопередачи равен сумме коэффициентов массопередачи отдельных звеньев и общая скорость процесса определяется скоростью самого быстрого процесса:  .
.
Кристаллохимические превращения складываются из ряда последовательно и параллельно протекающих реакций: физическая адсорбция газа на поверхности твёрдого; химическая адсорбция; обмен электронами; растворение первых порций образующегося соединения в исходном веществе; образование новой фазы – образование границы раздела фаз; рост новой фазы. В начальный период, пока идёт накопление продуктов реакции до образования новой фазы, скорость процесса минимальна (индукционный период). После образования границы раздела фаз скорость процесса увеличивается пропорционально росту поверхности раздела фаз (автокаталитический период). После создания единого фронта реакции, или после прохождения реакции через середину реагирующего образца, скорость реакции падает, в пределе, до 0 (период усреднённого фронта реакции).

| Благодаря наличию процесса адсорбции и явления автокатализа гетерогенные процессы называют адсорбционно-автокаталитическими. Скорость кристаллохимических превращений в значительной степени зависит от температуры, так как именно с повышением температуры возрастает кинетическая энергия частиц, скорость их движения в узлах кристаллической решётки, что приводит к увеличению скорости. |
| Рисунок 2 – Зависимость скорости автокаталитического процесса от продолжительности |
Важнейшая задача гетерогенной кинетики — установление режима и лимитирующих стадий процесса. Скорость массопередачи в ламинарном и неподвижном слоях зависит от их толщины. С повышением скорости потока толщина δ пограничного слоя уменьшается по закону: 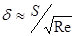 . Уменьшение толщины слоя снижает величину концентрационной диффузии.
. Уменьшение толщины слоя снижает величину концентрационной диффузии.
Отличительными признаками гетерогенных процессов, лимитируемых внешней диффузией будут:
1. Величина коэффициента массопередачи β зависит от скорости потока.
2. Диффузионное сопротивление 1/β не зависит от времени процесса.
3. После прерывания процесса и последующего его возобновления его кинетика характеризуется теми же параметрами.
4. Скорость процесса слабо зависит от температуры.
Отличительные признаки гетерогенных процессов, лимитируемых внутренней диффузией, следующие.
1. Скорость процесса не зависит от скорости движения газа.
2. Скорость зависит от пористости тела.
3. Диффузионное сопротивление растет со временем.
При низких температурах процесса, протекающего в кинетическом режиме, лишь небольшая часть молекул находится в активированном состоянии. Следовательно, лишь ограниченное число молекул может вступить в химическое взаимодействие. Общая скорость процесса будет определяться самой медленной стадией - химическим актом. Говорят, что процесс протекает в кинетическом режиме. С ростом температуры количество активированных молекул возрастает по экспоненте, значит, такая же зависимость будет характерна и для общей скорости процесса:  , где А —функция, зависящая от структуры твердого, характера поверхности и ряда других факторов; Е —энергия активации химической реакции.
, где А —функция, зависящая от структуры твердого, характера поверхности и ряда других факторов; Е —энергия активации химической реакции.
Отличительными особенностями процессов, протекающих в кинетическом режиме, будут:
1) независимость скорости реакции от скорости газового потока или интенсивности перемешивания флюидной фазы,
2) резкое увеличение скорости процесса с подъемом температуры,
3) довольно часто наблюдаемый автокаталитический ход процесса.
В пирометаллургии при осуществлении процессов в области высоких температур с реакциями, протекающими в кинетической области, приходится встречаться довольно редко. Гораздо чаще общую скорость процесса лимитирует внешняя или внутренняя диффузия.
В тех случаях, когда скорости химического акта и диффузионного переноса сопоставимы, говорят о протекании процесса в переходном (промежуточном) режиме. Строго говоря, нельзя говорить о чисто кинетическом или диффузионном режиме. Все гетерогенные процессы являются переходными с большим или меньшим отклонением от кинетического режима в диффузионную область. Однако для удобства математического описания кинетики целесообразно выделять факторы, определяющие в целом скорость гетерогенного процесса.
Если процесс осуществляется в кинетическом режиме, когда массоперенос вещества не влияет на общую скорость процесса, такая характеристика как порядок реакции, полностью применима к описанию гетерогенного процесса. Однако, порядок реакции не определяет механизм реакции. При гетерогенных процессах возрастает вероятность многостадийности химической реакции. Если же процесс идет в диффузионном режиме, то при определении порядка реакции следует помнить, что эта кинетическая характеристика относится уже не к химическому акту, а к процессу в целом. То же следует сказать и об энергии активации. Энергия активации гетерогенных химических реакций, находящихся в диффузионной области является интегральной активационной характеристикой процесса, а не реакции. Поэтому в литературе при использовании этой характеристики, как правило, употребляют термин «кажущаяся энергия активации». Количественное значение кажущейся энергии активации процесса может служить качественной характеристикой режима, в котором осуществляется гетерогенный процесс. При больших значениях Е акт (Е >60 кДж/моль) можно с известной долей осторожности говорить о протекании процесса в кинетической или переходной области. Малые значения энергии активации (Е< 60 кДж/моль) свидетельствуют о существенном влиянии диффузионных затруднений. При оценке механизма и режима гетерогенных процессов более надежен аналитический метод, связанный с использованием полуэмпирических кинетических уравнений.
Механизм и кинетика диссоциации веществ в твёрдых фазах. Термическое разложение карбонатов, оксидов и сульфидов - это реакции превращения твердого вещества А в твердый продукт В с выделением газовой фазы С: АТВ = В ТВ + СГ. Такие превращения обычно подчиняются закономерностям топохимических (автокаталитических) реакций. Препятствием в начальной стадии процесса является зарождение новой фазы и появление межфазной границы. В ионной кристаллической решетке карбоната или окисла закономерно чередуются в пространстве катионы металла Mez+ и анионы (CO32- или О2-). Это определяет равновесие сил межчастичного взаимодействияи и устойчивость кристаллической решетки. Искажения и дефекты кристаллической решетки вызывают возрастание термодинамического потенциала исходной фазы ΔG и оказываются активными местами для начальных стадий процесса, чему способствует появление чужеродные частицы в результате распада исходных соединений: CO32-→ O2-+(CO2)адс; О2- — 2е-→ О; Ме2+ + 2е → Me; 2О → О2.
Появление новых частиц в недрах старой фазы нарушает симметрию и вызывает местную деформацию решетки, что предопределяет возможность возникновения новой фазы. Отклонения по составу и распределению энергии от средних статистических значений в отдельных микроучастках системы (флуктуации) могут быть гетерофазными, т. е. сопровождаться появлением новых атомов или молекул и их обособлением в новую фазу. Образование частицы продукта диссоциации В, состоящего из т молекул, сопровождается изменением изобарного потенциала: ΔG = m ΔGV +S· σ. Оно слагается из изменения в объеме, приходящегося на одну молекулу ΔGV, и энергии напряжения S· σ, возникающей в результате внедрения новых частиц В в решетку исходного вещества А. Падение величины объемного термодинамического потенциала, происходящее при образовании новых частиц, усиливается с увеличением их размера. С увеличением m возрастает энергия напряжения. В результате суммарная величина ΔG процесса возникновения флуктуации и образования новых частиц при определенном критическом их размере тк проходит через максимум (рисунок 3). Ему соответствуют:  . Частицы продукта реакции, образованные числом частиц ниже критических т < тк,неустойчивы.
. Частицы продукта реакции, образованные числом частиц ниже критических т < тк,неустойчивы.
Процесс укрупнения затрудняется, так как требует возрастания изобарного потенциала. Частицы, для которых т > тк устойчивы и способны к дальнейшему самопроизвольному росту.

| 
|
| Рисунок 3 – Зависимость DG системы при образовании зародыша новой фазы от числа частиц в зародыше | Рисунок 4 – Кривые топохимических реакций с развитым (1) и неразвитым (2) автокатализом |
Таким образом, возникают зародыши новой фазы, которые своим развитием и укрупнением обеспечивают рост продукта реакции диссоциации. Развитие возникающих зародышей и их рост требует преодоления энергетического барьера.
Необходимая величина энергии (энергия активации – Е)обеспечивает разрыхление кристаллической решетки и диффузию частиц к месту формирования новой фазы. Учитывая сказанное, кинетику роста зародышей и выделения продукта диссоциации твердых веществ можно представить уравнением:  . Первый экспоненциальный множитель
. Первый экспоненциальный множитель 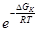 отражает скорость образования зародышей -
отражает скорость образования зародышей -  , второй - скорость их роста -
, второй - скорость их роста -  . Если
. Если  >
>  , то кинетическая кривая отражает все фазы процесса (рисунок 4, кривая 1). Нижняя ее ветвь (медленного нарастания а) относится к индукционному периоду процесса, когда формируются зародыши и появляется граница между старой и новыми фазами. Вторая фаза (быстрого нарастания а и скорости разложения исходного вещества) отражает возрастание межфазной поверхности и автокаталитическое ускорение процесса. Верхняя ветвь кривой свидетельствует о замедлении процесса в связи с уменьшением ее границы раздела фаз. Однако дополнительные явления искажают эту зависимость.
, то кинетическая кривая отражает все фазы процесса (рисунок 4, кривая 1). Нижняя ее ветвь (медленного нарастания а) относится к индукционному периоду процесса, когда формируются зародыши и появляется граница между старой и новыми фазами. Вторая фаза (быстрого нарастания а и скорости разложения исходного вещества) отражает возрастание межфазной поверхности и автокаталитическое ускорение процесса. Верхняя ветвь кривой свидетельствует о замедлении процесса в связи с уменьшением ее границы раздела фаз. Однако дополнительные явления искажают эту зависимость.
Осложнения возникают при наличии толстого слоя продуктов реакции, когда процесс начинает тормозиться диффузионными явлениями. Картина процесса становится еще сложнее, если дополнительно учитывать влияние теплообмена.
Скорость процесса изменяется с температурой по экспоненциальному закону: 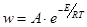 .
.
Механизм и кинетика окисления металлов. Окисление металла сопровождается образованием оксида в виде оксидного слоя. Скорость окисления и роста оксидного слоя быть связана с механизмом переноса реагирующих веществ внутри этого слоя и реакциями на межфазных границах. Согласно представлениям о структуре ионных кристаллов, к которым можно отнести оксидные фазы, процессы диффузии обусловлены дефектами кристаллической решетки. Это - внедрение ионов в междоузлие и наличие вакантных узлов:  ; внедрение частичек металла в междоузлие решетки оксида в виде ионов и электронов: Ме = МеО2+ + 2е. В результате образования анионных вакансий
; внедрение частичек металла в междоузлие решетки оксида в виде ионов и электронов: Ме = МеО2+ + 2е. В результате образования анионных вакансий  и электронов появляются новые слои оксида:
и электронов появляются новые слои оксида:  .
.
На первой стадии реагирования происходит хемосорбция кислорода на поверхности с последующим реагированием и образованием ионов. Возможно взаимодействие кислорода с ионами металла междоузлий и электронами:  . Возможны и другие реакции.
. Возможны и другие реакции.
Т. о., многостадийный окислительный процесс развивается в зависимости от толщины и природы образующегося покрытия и возможных в нем диффузионных перемещений. Покровный окисный слой в определенной мере предохраняет металл от воздействия газа. Его защитные свойства связаны с механической прочностью, компактностью образующегося окисла и сцепляемостью частиц последнего с металлом. Для многих металлов (алюминий, свинец, цинк, никель, хром, железо) молекулярный объем образующегося оксида больше атомного объема израсходованного металла. В этих условиях формируются сплошные, плотно прилегающие к металлу покрытия, обладающие повышенными защитными свойствами. Кадмий, натрий, кальций, барий образуют оксиды с уменьшением объема продукта реакции. При этом образуется пористый слой оксида, слабо сцепленный с металлом и не способный изолировать металл от прямого воздействия газообразного реагента.
Механизм и кинетика окисления металлов и углерода. Процесс протекает по следующим последовательным стадиям: 1. доставка окислителя из ядра газового потока к поверхности раздела фаз; 2. адсорбция кислорода на поверхности углерода; 3. образование адсорбированных продуктов реакции на поверхности; 4. десорбция продуктов в газовую фазу; 5. отвод газообразных продуктов от поверхности. Стадии 2, 3, 4 – кристаллохимические, а стадии 1, 5 стадиями переноса реагентов -диффузионными. Поскольку конвективная диффузия протекает гораздо быстрее молекулярной, то для ускорения переноса нужно уменьшить толщину пограничного диффузионного слоя, что видно из уравнения  . Уменьшению толщины пограничного диффузионного слоя и ускорению молекулярной диффузии способствует повышение скорости потока, а также увеличение размеров куска твердого тела. Ускорение молекулярной диффузии в результате повышения температуры сравнительно невелико.
. Уменьшению толщины пограничного диффузионного слоя и ускорению молекулярной диффузии способствует повышение скорости потока, а также увеличение размеров куска твердого тела. Ускорение молекулярной диффузии в результате повышения температуры сравнительно невелико.
Скорость кристаллохимических стадий процесса можно описать уравнением:  , где: А - функция характера поверхности ориентации частиц; k - константа скорости реакции.
, где: А - функция характера поверхности ориентации частиц; k - константа скорости реакции.
Скорость химических стадий экспоненциально возрастает с температурой: 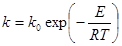 .
.
Кинетические стадии процесса включают процессы адсорбции, собственно химической реакции и десорбции. При химической адсорбции кислорода и диоксида углерода и происходит растяжение и разрыв внутримолекулярных связей и образование поверхностных адсорбированных комплексов.
Тип образующихся комплексов и механизм первичного взаимодействия углерода с кислородом определяется его концентрацией последнего, температурой, физическим состоянием поверхности и структурой графита. Графит имеет гексагональную слоистую решетку с параллельными базисными плоскостями. В каждой базисной плоскости атомы углерода размещены в вершинах правильных шестиугольников со стороной 0,141 нм и связаны с тремя ближайшими соседями прочными ковалентными (гомеополярными) связями с энергией ~500 кДж/моль. Структурные и энергетические особенности графита придают ему высокую адсорбирующую способность.
Углерод образует с кислородом следующие типы адсорбционных комплексов:
1.Пероксидная форма - С(реш)О2(адс); 2. Кето-комплекс - С(реш)О(адс); 3. Кетенный комплекс - С(реш)СО(адс).
Пероксидная форма образуется при адсорбции молекулы О2 на двух атомах углерода с одной и двумя ненасыщенными связями. Кето-комплекс - на двух атомах углерода с одной ненасыщенной связью при адсорбции двух атомов кислорода. Кетенный комплекс - образуется из диссоциирующей молекулы СО2 на двух атомах углерода с одной ненасыщенной связью с одновременным образованием кето-группы.
Разрушение адсорбционных комплексов может происходить по следующим схемам. Пероксидная форма уже при температурах 300 — 400 °С отдает в газовую фазу СО2 с захватом при этом слабо удерживаемого атома углерода по реакции: С(реш)О2(адс) = СО2(газ)-
Большую прочность имеет кетенная группа, отдающая в газовую фазу СО: С(реш)СО(адс) = С(реш) + СО(газ).
Наиболее прочен кето-комплекс, разрушаемый либо в результате удара молекул кислорода (С(реш)О(адс) =СО), либо термического распада при температурах выше 1600 °С (С(реш)О(адс) + С(реш) + О2 = СО + CO2).
Суммарная скорость гетерогенного процесса зависит, как известно, от скоростей отдельных его стадий. Если скорость одной из последовательных стадий значительно (на порядок) меньше других, то суммарная скорость определяется скоростью этой наиболее медленной — лимитирующей стадии. При низких температурах константа скорости химического звена k мала, что соответствует реализации кинетического (химического) режима процесса. При повышении температуры величина второго слагаемого сначала становится заметной, а затем приобретает все большее и большее значение. Процесс переходит в диффузионный режим, проявляются новые закономерности его скорости (влияние потока газа, ослабленное влияние температуры).
Взаимодействие кислорода с углеродом еще до перехода процесса во внешнедиффузионный режим, наблюдающийся обычно при температурах >900 °С, в температурном интервале 500 - 900 °С может тормозиться внутренней диффузией в объем частицы углерода. Для случая взаимодействия углерода с СО2 это наблюдается при более высоких температурах.
Механизм и кинетика восстановления оксидов. Реакции восстановления являются, как правило, гетерогенными, где реагенты представляют две или более фаз и peaкция протекает на границах раздела фаз.
В практике металлургического производства в настоящее время возросли возможности получения исходных оксидов с минимальным количеством примесей. При переработке таких материалов существенное значение имеют кинетические закономерности восстановления чистых оксидов, с комплексным учетом явлений тепло- и массообмена, сопровождающих процесс восстановления. С другой стороны, в большей степени приходится использовать руды, содержащие несколько оксидов - комплексные руды и концентраты. В ряде случаев необходимо вводить добавки оксидов, в шихту. В большинстве реальных металлургических агрегатов в процессах восстановления участвуют не чистые оксиды, а более сложные системы и реакции, как правило, протекают в условиях изменяющихся температур.
Процесс восстановления твердого оксида газом включает несколько последовательных стадий: 1) диффузию реагентов к межфазной реакционной поверхности; 2) химическую реакцию на межфазной поверхности; 3) диффузию продуктов от межфазной поверхности.
К числу факторов, определяющих скорость процесса восстановления можно отнести: 1) температуру, влияющую на скорость химической реакции и диффузию; 2) химический и минералогический состав, микроструктуру, пористость, форму и размер оксидных частиц; 3) вид газа-восстановителя, состав, парциальное давление газа-восстановителя, скорость его движения.
Если в общем виде реакцию восстановления оксида представить в виде уравнения MeOТВ + В ↔ МеТ +ВО, то суммарная скорость восстановления w представляет собой разность скоростей протекания реакции в прямом и обратном направлениях.
Температурная зависимость скорости восстановления определяется температурными зависимостями ka. Газообразный восстановитель и газообразный продукт реакции диффундируют в противоположных направлениях через поры в твердом слое продукта восстановления и в газовой фазе (пограничном газовом слое, окружающем частицу оксида).
Адсорбционно-автокаталитическая теория. Восстановительный процесс является топохимическим и сосредоточивается на границе раздела старой и новой фаз. Для него справедливы общие закономерности топохимических реакций. В первом, индукционном, периоде только в отдельных активных местах поверхности оксида реагирование приводит к появлению зародышей новой фазы. Во втором периоде вокруг зародышей развивается и увеличивается реакционная поверхность, на которой совершаются превращения. В результате наблюдается автокатализ - самоускорение процесса. В третьем периоде отдельные реакционные зоны сливаются в общую поверхность, которая сокращается по мере ее перемещения в глубь кусочка оксида. В результате наблюдается самозамедление процесса.
В условиях избытка восстановителя наблюдается зональность — одновременное осуществление различных ступеней восстановления оксидов и послойное распределение их в куске исходного материала согласно диаграмме металл - кислород. Для оксидов железа можно обнаружить многозональность при высоких температурах, когда соизмеримы скорости восстановления отдельных оксидов.
Кристаллохимические превращения состоят из отдельных звеньев: адсорбция молекул восстановителя на поверхности оксида (МеО + СО = МеО • СОадс ); химическая реакция МеО • С0адс = Me • СО2адс; кристаллохимические превращения конденсированной фазы; десорбция газообразного продукта реакции в газовую фазу (Me • С02адс = Me + СО2газ).
В многостадийных превращениях скорость всего процесса лимитируется наиболее медленным звеном. В согласии с опытом медленным звеном восстановительного процесса являются кристаллохимические превращения или десорбция СО2.
Диффузионно-кинетическая теория. Стадия самой химической реакции тесно связана с особенностями кристаллохимических превращений, и ее кинетические возможности в определенных сопоставимых условиях можно характеризовать величиной константы скорости К. Диффузионный поток восстановителя преодолевает внешнее сопротивление около поверхности оксида, вызываемое встречным потоком отходящих продуктов реакции - СО2. Более существенным препятствием является внутреннее сопротивление, которое проявляется при диффузии восстановителя через поры и трещины слоя твердых продуктов реакции. К этому следует добавить и диффузионное перемещение ионов металла и кислорода в кристаллической решетке твердых продуктов и совершающиеся в них химические превращения. В очень плотных материалах, в которых диаметр пор меньше длины свободного пробега молекул, диффузионный механизм переноса газа осложняется кнудсеновским молекулярным течением. В противоположность обычной диффузии оно увеличивается с давлением и падает с температурой. Появление тонкой пористости влечет за собой своеобразие кинетических закономерностей восстановительного процесса. При относительно высоких температурах в тончайших каналах может развиваться активированная диффузия под влиянием силового поля частиц на поверхности каналов. Интенсивность такого переноса, связанного с преодолением энергетического барьера, значительно возрастает с повышением температуры.
Перенос восстановителя к реакционной зоне описывают простой газовой диффузией и оценивают эквивалентной величиной эффективного коэффициента диффузии D и толщины покровного слоя х. Кинетическая область реагирования характеризуется явным превышением скорости диффузии над скоростью химических превращений.
 При различном сочетании К и D/x проявляется тормозящее действие различных стадий и процесс развивается со своими характерными признаками. Рисунок 5 показывает рост во времени толщины покровного слоя продукта восстановления х и реакционной зоны, углубляющейся в пределе до середины куска, на расстояние а. Диффузионное распределение парциального давления восстановителя в куске материала совершается между величинами давления в исходной газовой фазе РСО и при равновесии реакции рСО. При относительно низких температурах и для материалов с сильно развитой пористостью или при хорошем их измельчении стадией, тормозящей восстановительный процесс, оказываются кристаллохимические превращения.
При различном сочетании К и D/x проявляется тормозящее действие различных стадий и процесс развивается со своими характерными признаками. Рисунок 5 показывает рост во времени толщины покровного слоя продукта восстановления х и реакционной зоны, углубляющейся в пределе до середины куска, на расстояние а. Диффузионное распределение парциального давления восстановителя в куске материала совершается между величинами давления в исходной газовой фазе РСО и при равновесии реакции рСО. При относительно низких температурах и для материалов с сильно развитой пористостью или при хорошем их измельчении стадией, тормозящей восстановительный процесс, оказываются кристаллохимические превращения.
В диффузионной области К > D/x и скорость восстановительного процесса определяется относительно медленной стадией диффузии. Диффузионный режим восстановительного процесса характерен для высоких температур, малой пористости и значительных размеров кусочков окисла. При высоких температурах возникающие осложнения с диффузией искажают обычные признаки процесса.
В переходной области процесс развивается, когда соизмеримы К и D/x, и на него оказывают влияние как кинетические, так и диффузионные факторы.
Примеры. Поведение оксидов железа, свинца, цинка в условиях доменной плавки. Поведение оксидов железа, свинца, цинка в условиях шахтной свинцовой плавки. Поведение оксидов железа, свинца, цинка в условиях Империал - Смелтинг процесса.
Поиск по сайту: