 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекция 4. Характеристика оксидных расплавов. Диаграммы состояния двухкомпонентных шлаковых систем
Все металлургические плавки, за редким исключением, дают кроме основного, ценного продукта, металла или сплава сульфидов, второй продукт – шлак, жидкий сплав, состоящий в основном из оксидов. При плавках рудного сырья объем полученного шлака обычно постоянно больше объема основного продукта. В особенности это относится к плавкам руд цветных металлов, при которых количество шлака по весу в несколько раз превышает количество основного продукта. Шлаки рудных плавок собирают в себе все компоненты пустой породы и должны содержать минимальное количество цветного металла.
1. Шлаки определяют в значительной мере и технологический, и экономический эффект плавки.
2. Шлаки выполняют целый ряд важных функций.
3. Шлак является коллектором пустой породы.
4. Шлак определяет состав футеровки печей в шлаковой зоне.
5. Шлаки являются средой, в которой протекают важные для процесса химические реакции; в ряде случаев основные процессы получения металлов протекают именно в шлаках. Так, при свинцовой восстановительной плавке силикаты свинца, растворенные в шлаках, восстанавливаются непосредственно из расплавов. При плавках никелевой окисленной руды на штейн сульфидирование никеля в основном происходит из шлаковой фазы. Степень сульфидирования и величина потерь металла зависит от протекания этих реакций.
6. Шлаки являются той средой, в которой происходит осаждение капель металла или штейна, обусловливая тем самым степень разделения металлической части шихты от пустой породы и определяя одну из основных форм потерь металла в шлаках – механические потери.
7. Шлак является телом сопротивления, при прохождении тока через которое в электротермических процессах в плавильных агрегатах выделяется тепло.
8. Шлаки и их состав определяют ту максимальную температуру, которую необходимо получать в печах при плавке.
9. Шлаки, входя во взаимодействие с металлической ванной при выплавке и рафинировании металлов и сплавов, определяют результаты рафинирования и концентрацию примесей в металле.
10.Шлак предохраняет металлическую и штейновую фазы от окисления кислородом газовой фазы печи.
11.Шлак сам является окислителем металлической и штейновой фазы. Процесс окисления протекает в соответствии с реакциями:
(МеО)Шл + [Me’]Ме = (Me’O)Шл + [Me]Ме
(МеО)Шл + [Me’S]Шт = (Me’O)шл + [MeS]Шт
12.В целом ряде случаев шлаки являются не отвальным, основным продуктом плавки, содержащим главный металл, отделяемый таким путем от примесей, концентрирующихся в других продуктах. Например, при восстановительной плавке железо-титановых руд.
13.Шлаки являются ''цементирующим средством'' в процессах агломерирующего обжига концентратов.
14.Правильный выбор шлака определяет результаты процесса плавки, и в металлургии большое внимание уделяется изучению природы и свойств шлака.
Химическая характеристика шлаков. Шлаки считаются сплавами оксидов. Содержание оксидов редко бывает меньше 90 %, а для подавляющего большинства шлаков содержание оксидов превышает 95 %. Кроме оксидов в состав шлака могут входить сульфиды (CaS; ZnS), сульфаты (ВаSО4), иногда галогениды CaF2, NaCl. Как механические примеси шлак может содержать включения металла и штейна. В шлаках могут растворяться газы, присутствующие в газовой фазе печи.
Оксиды, присутствующие в шлаках, делятся на кислотные, основные и амфотерные. Однако, эти термины базируются на старых и только в известной мере правильных понятиях об ангидридах и основаниях, т.е. об оксидах, дающих при растворении в воде кислоты или щёлочи. Согласно электронно-координационной теории кислотой следует считать вещество, частицы которого могут принять электронную пару с образованием координационной связи. Основание – это вещество, частицы которого могут дать электронную пару. Другими словами, основание – донор, а кислота – акцептор электронных пар. С этой точки зрения, кислотность или основность являются относительными свойствами. Одно и то же вещество может быть кислотой по отношению ко второму веществу и основанием для третьего. Однако, принятая классификация оксидов на основные, кислотные и амфотерные устраивает, и ею пользуются.
Кислотные оксиды (КО) в шлаковой системе (SiO2, TiO2, V2O5, P2O5, B2O3, As2O3, SnO2) играют роль кислот, образуя с основными окислами солеобразные соединения. Кислотные свойства убывают от V2O5 и P2O5 к SiO2 и B2O3. КО играют роль сеткообразователей при формировании шлаков.
Основные оксиды: CaO, MgO, BaO, FeO, MnO, Na2O, K2O, PbO, NiO, Cu2O, SnO. Основность оксидов убывает в следующем порядке: BaO, Na2O, CaO, MgO, MnO, CdO, FeO. Основные оксиды при формировании шлаков играют роль модификаторов, сеткоразрушителей.
Амфотерные оксиды: Al2O3, Cr2O3, Fe2O3, ZnO. Амфотерные оксиды в шлаках с большим количеством основных оксидов играют роль кислот, в шлаках с большим количеством кислотных оксидов – роль оснований. С сильными основаниями они образуют алюминаты, ферриты, цинкаты, хроматы – CaO∙Fe2O3, CaO∙Al2O3, Na2O∙ZnO. В кислых шлаках амфотерные оксидов пополняют недостаток оснований и образуют соединения типа ZnO∙ SiO2 - силикат оксида цинка.
В затвердевшем виде оксиды, входящие в шлак, в большей или меньшей степени связаны между собой в солеобразные соединения: силикаты - 2CaO∙SiO2, 2FeO·SiO2, титанаты - CaO·ТiO2, FeO·ТiO2, фосфаты - CaO∙P2O5, алюминаты - CaO∙Al2O3 и т.д. Все эти соединения в твердом состоянии различимы под микроскопом. В расплавленном состоянии эти соединения в большей или меньшей степени диссоциированы на ионы и (или) простые оксидов.
Наиболее простой химической характеристикой шлака является его химический состав в весовых или молярных процентах. Такая характеристика шлака не наглядна и мало удобна для пользования. Для сравнения различных шлаков пользуются их условной характеристикой – степенью кислотности (степенью основности). Степень кислотности – это отношение массы кислорода в кислотных окислах к массе кислорода в основных оксидах: 
Степень кислотности заводских шлаков меняется в пределах 0,5÷3. Шлаки со степенью кислотности 1 называют моносиликатными, со степенью кислотности 2 – бисиликатными. Шлаки со степенью кислотности 1,0 и меньше считают основными шлаками, а при степени кислотности 2,0 и более – кислыми шлаками. Шлаки со степенью кислотности между 1 и 2 – нейтральные. (Основность шлака – это отношение массы кислорода основных оксидов к массе кислорода кислотных оксидов). Названная упрощенная характеристика не может заменить полного химического состава шлака и ею следует пользоваться только при сравнении шлаков одного типа, получающихся при переработке сходных видов сырья. Для более точной характеристики кислотности шлаков следует пользоваться не концентрацией, а активностью ионов кислорода.
Плавкость шлаков. Промышленные шлаки являются многокомпонентными системами. Большинство шлаков имеют 2-3 основных компонента (реже 4), а остальные присутствуют в незначительном количестве, в виде примесей. Это позволяет рассматривать примеси, содержащиеся в небольших количествах, как не оказывающие существенного влияние на свойства шлаковых систем.
Так, рафинировочные шлаки считаются двойными сплавами оксидов рафинируемого металла и SiO2 или CaO; шлаки конвертирования штейнов являются сплавами оксидов железа и SiO2, шлаки медной и свинцовой шахтных плавок – FeO, SiO2, CaO; шлаки доменных плавок более чем на 95% состоят из SiO2, CaO, Al2O3. Поэтому удовлетворительные данные по плавкости шлаков можно получить из диаграмм состояния соответствующих двойных и тройных систем.
Шлаки, как многокомпонентные системы не имеют определенной точки плавления, а плавятся в интервале температур. Исключения составляют некоторые сплавы строго определенного состава, соответствующие прочным химическим соединениям или эвтектикам.
Плавкость системы FeO - SiO2. В диаграмме (рисунок 1) можно отметить образование устойчивого химического соединения – Fe2SiO4 (2FeO·SiO2) - фаялита - с температурой плавления 1240 °С, и одно неустойчивое соединение со скрытым максимумом FeO·SiO2 – грюнерит с температурой разложения 1160°С. В системе образуется 2 эвтектики с температурами 1220 и 1130 °С. В области SiO2 имеется область расслаивания. Точка плавления FeO 1370 °С. Наиболее легкоплавкая эвтектика (Тпл=1130 °С) образована бисиликатом и моносиликатом оксида железа (Fe2+) и содержит 41,5% SiO2. В части диаграммы, примыкающей к SiО2, в расплавленном состоянии образуются нерастворимые жидкости.
Теперь с точки зрения ионной структуры расплавленных шлаков разберем кристаллизацию в системе FeO-SiO2. Возьмем сплав, соответствующий по составу точке 1. В расплавленном состоянии в шлаке присутствуют ионы Fe2+, O-2, SiO4-4. Выделение в твердую фазу растворенного вещества происходит после достижения произведение растворимости: Lp = (A-) · (K+). Как только температурная прямая пересечёт линию ликвидус, достигается произведение растворимости FeO и начинается его кристаллизация. С понижением температуры Lр уменьшается, поэтому дальнейшая кристаллизация возможна и при понижении концентрации катионов Fe2+ и анионов O-2 в расплаве. Одновременно с обеднением по Fe2+ и O-2 расплав обогащается по SiO4-4. При понижении температуры до значений соответствующих плавлению эвтектики из раствора будут кристаллизоваться одновременно и FeO и Fe2SiO4. При составах сплавов, соответствующих точкам эвтектики и химическому соединению (точки 2 и 3 на графике) кристаллизация будет происходить при постоянной температуре при температуре эвтектики (1220 °С) для эвтектического сплава, и при температуре плавления химического соединения (1240 °С) для расплава соответствующего состава.
В практике цветной металлургии требуются температуры плавления шлаков 1050-1100 °С. Основные шлаковые компоненты имеют высокие температуры плавления: ТплFeO = 1370 °C; ТплSiO2 = 1710 °C; ТплCaO = 2570 °C; ТплMgO = 2800 °C; ТплAl2O3 = 2052 °C. Однако уже в двойных сплавах образуется несколько эвтектик. В системе FeO - SiO2 эвтектики плавятся при 1130-1220 °С.
Диаграмма состояния системы CaO – SiO2. Температура плавления SiOa и СаО равна соответственно 1710 и 2570 °С. В этой системе (рисунок 2) образуются два прочных химических соединения: CaO-SiО2 — бисиликат (Тпл=1540 °С) и 2CaO-SiО2 — моносиликат оксида кальция (Тпл=2130°С). Образуется два неустойчивых химических соединения; 3CaO·2SiO2 и 3CaO·SiO2. Одноиз них разлагается при температуре 1470 °С с образованием моносиликата и жидкой фазы, а другое соединение устойчиво в области температур 1250—1900 °С.
По характеру максимума кривой ликвидуса (по сингулярным точкам) можно судить о степени прочности (степени диссоциации) того или иного химического соединения при расплавлении. Сравнивая положение линий ликвидус около химических соединений CaO·SiО2 и 2СаО·SiO2, можно прийти к выводу, что моносиликат прочнее бисиликата. Температуры плавления эвтектик, которые образуются между соседними химическими соединениями в этой системе, равны 2065, 1470 и 1436 °С.

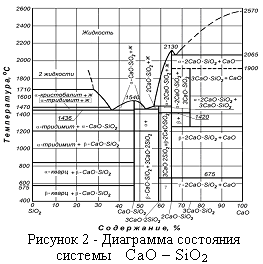
Горизонтальные линии, примыкающие к СаО, относятся к температурам превращения в твердом состоянии и отображают температуры полиморфных превращений химических соединений в твёрдом состоянии. Например, линия при температуре 575 °С относится к полиморфному переходу β-кварца в α-кварц, а линия при 870 °С – к переходу α-кварца в тридимит.
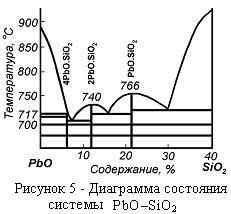
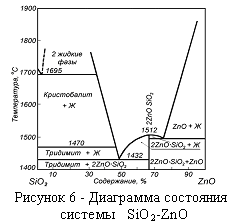
Диаграммы состояния систем PbO – SiO2 и SiO2 – ZnO. Большое значение для понимания и прогнозирования процессов окислительного и агломерирующего обжига свинцовых и цинковых концентратов имеет поведение оксидов свинца, цинка и кремния (рисунок 5 и 6).
Диаграммы состояния системы CaO-SiO2-Al2O3. Более полные сведения о свойствах шлаков можно получить на основании анализа тройных диаграмм плавкости. Тройные диаграммы позволяют:
· Определять температуру плавления и затвердевания тройного сплава заданного состава, учитывая при этом момент начала кристаллизации и состав выпадающей твердой фазы, момент окончания затвердевания расплава и состав тройной эвтектики.
· Подбирать состав тройного сплава, отвечающий заданной температуре плавления (и вязкости при наличии на диаграммах кривых постоянной вязкости при постоянной температуре) в данной области диаграммы.
· Составлять диаграммы псевдобинарных систем путем проведения вертикальных разрезов и нанесение на них линий пересечения секущей плоскости с поверхностью ликвидуса тройной системы.
· Определить графически процентное содержание двух тройных сплавов в их смеси, необходимое для получения другого тройного сплава заданного состава, пользуясь правилом рычага.
Можно решать и обратные задачи.
Условно делят шлаки на шлаки чёрной и цветной металлургии. К первым относятся шлаки, свойства которых в основном определяются взаимодействиями в системе CaO-SiO2-Al2O3. Ко второй - систему CaO-SiO2–FeO.
Поиск по сайту: