 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекции 11. Физико-химические основы переработки сульфидов
Сера образует при комнатной температуре кристаллы ромбической формы. При температуре 99.5 ºС ромбическая сера переходит в моноклинную, которая плавится при 119 ºС. При температуре 444.6 ºС и давлении 760 мм. рт. ст. сера кипит, образуя пары, состоящие из молекул  и
и 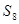 . При повышении температуры многоатомные молекулы превращаются в молекулы
. При повышении температуры многоатомные молекулы превращаются в молекулы 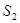 . Около 900 ºС практически все молекулы серы становятся двухатомными. При температурах выше 1500 ºС появляются одноатомные молекулы.
. Около 900 ºС практически все молекулы серы становятся двухатомными. При температурах выше 1500 ºС появляются одноатомные молекулы.
Термодинамические характеристики двухатомной серы близки к характеристикам кислорода, т.е. при расчетах в качестве первого приближения можно считать их совпадающими с аналогичными величинами для кислорода.
Все металлы обладают определенным сродством к сере.
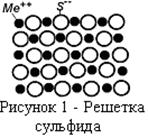 Прочность сульфидов определяется величиной электростатических сил между катионом металла и анионом серы, находящимися в узлах кристаллической решетки. Из сравнения величин ионных радиусов (
Прочность сульфидов определяется величиной электростатических сил между катионом металла и анионом серы, находящимися в узлах кристаллической решетки. Из сравнения величин ионных радиусов (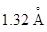 у кислорода и
у кислорода и 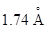 у серы) ясно, что силы взаимодействия больше в оксидах, нежели в сульфидах тех же металлов.
у серы) ясно, что силы взаимодействия больше в оксидах, нежели в сульфидах тех же металлов.
При высоких температурах сера реагирует со всеми металлами, образуя сульфиды. Ряд металлов образует несколько сульфидов: например, железо -  и
и 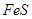 ; медь -
; медь - 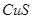 и
и 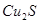 ; никель -
; никель - 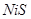 и
и 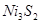 . Высшие сульфиды при повышении температуры отщепляют часть серы, превращаясь в прочные низкие сульфиды.
. Высшие сульфиды при повышении температуры отщепляют часть серы, превращаясь в прочные низкие сульфиды.
Реакции образования и диссоциации сульфидов описываются уравнением: 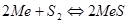 . Металл и сульфид в зависимости от температуры могут быть конденсированными или газообразными:
. Металл и сульфид в зависимости от температуры могут быть конденсированными или газообразными: 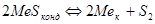 , (
, ( );
);  , (
, (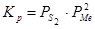 );
); 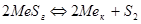 , (
, (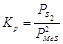 );
); 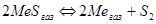 , (
, (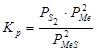 ).
).
Выражения для констант равновесия аналогичны константам равновесия при диссоциации оксидов. Все формулы, описывающие закономерности диссоциации оксидов в различных условиях, будут пригодны для описания диссоциации сульфидов в подобных условиях после замены термодинамической характеристики оксида аналогичной характеристикой сульфида.
Зависимость 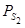 от температуры выражается в виде экспоненты.
от температуры выражается в виде экспоненты.
Хотя электростатические силы взаимодействия между 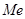 и
и 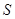 меньше, чем между
меньше, чем между 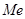 и
и 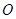 ,
, 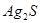 и Hg2S прочнее, чем соответствующие оксиды, а прочность
и Hg2S прочнее, чем соответствующие оксиды, а прочность 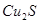 и
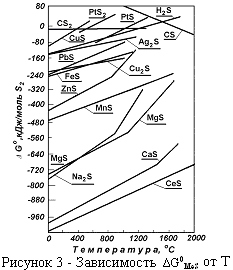
и 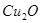 почти одинаковые. На рисунках 2 и 3 представлены графики температурной зависимости
почти одинаковые. На рисунках 2 и 3 представлены графики температурной зависимости 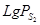 и
и 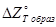 образования сульфида. В точках фазовых превращений металл и сульфида кривые имеют излом. Характеристики сульфидов по
образования сульфида. В точках фазовых превращений металл и сульфида кривые имеют излом. Характеристики сульфидов по 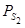 и
и 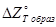 равноценны, так как они связаны между собой известным выражением:
равноценны, так как они связаны между собой известным выражением: 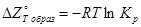 .
.
Термодинамические характеристики сульфидов могут быть определены путем изучения равновесий восстановления сульфидов водородом: 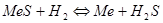 . Величина константа равновесия реакции
. Величина константа равновесия реакции 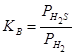 определяется по данным анализа равновесной газовой фазы на сероводород
определяется по данным анализа равновесной газовой фазы на сероводород 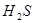 и водород
и водород 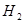 . Зная величину константы диссоциации сероводорода
. Зная величину константы диссоциации сероводорода 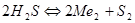 ;
; 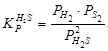 , можно вычислить константу диссоциации сульфида
, можно вычислить константу диссоциации сульфида 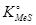 :
: 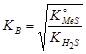 ; и
; и 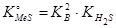 , где
, где 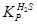 определена для широкого интервала температур.
определена для широкого интервала температур.

При решении задач по распределению серы между несколькими металлами, поведению сульфидов в растворах и восстановлению сульфидов целесообразно использовать в качестве термодинамических характеристик величины упругостей диссоциации. При диссоциации сульфида в расплаве 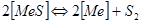 равновесное давление серы определяется следующим выражением:
равновесное давление серы определяется следующим выражением:
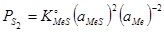 , где
, где
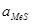 и
и 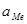 - активности сульфида и металла в растворе,
- активности сульфида и металла в растворе,
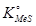 - константа диссоциации конденсированного сульфида.
- константа диссоциации конденсированного сульфида.
По исследованиям А. Н. Вольского расплавы 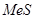 достаточно близки к идеальным растворам, так что, без значительной ошибки можно определить активности составляющих расплава через концентрации и растворимости, как у идеального раствора. При ограниченной растворимости составляющей расплава ее активности определятся выражениями:
достаточно близки к идеальным растворам, так что, без значительной ошибки можно определить активности составляющих расплава через концентрации и растворимости, как у идеального раствора. При ограниченной растворимости составляющей расплава ее активности определятся выражениями: 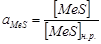 ;
; 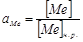 , а при неограниченной растворимости активность составляющей может быть принята равной ее молярной доле.
, а при неограниченной растворимости активность составляющей может быть принята равной ее молярной доле.
 В сульфидных системах возможно образование растворов с высокой концентрацией металла. Так, в системе
В сульфидных системах возможно образование растворов с высокой концентрацией металла. Так, в системе  при температуре 995ºС в расплаве находится
при температуре 995ºС в расплаве находится  и
и 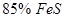 , при 1200 ºС -
, при 1200 ºС - 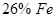 и
и 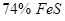 . Еще более высокие концентрации металла возможны в системе
. Еще более высокие концентрации металла возможны в системе 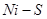 . В таких расплавах концентрация растворителя отличается от единицы и должна учитываться при расчете
. В таких расплавах концентрация растворителя отличается от единицы и должна учитываться при расчете 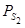 .
.
Зависимость 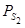 в системе
в системе 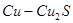 от содержания
от содержания 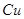 и
и  в системе в первом приближении подчиняется закону Рауля.
в системе в первом приближении подчиняется закону Рауля.
Пример1. Рассмотрим задачу о рафинировании свинца от меди при помощи серы.
При температуре завершения рафинирования (330 ºС) раствор меди в жидком свинце находится в равновесии с двумя конденсированными фазами - 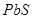 и
и  .
. 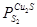 определится по уравнению:
определится по уравнению: 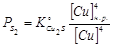 . Приравнивая
. Приравнивая 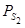 при диссоциации
при диссоциации  в присутствии раствора меди величине
в присутствии раствора меди величине 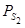 при диссоциации
при диссоциации 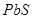 в присутствии чистого свинца, т.е.
в присутствии чистого свинца, т.е. 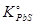 , найдём конечную концентрацию меди в свинце:
, найдём конечную концентрацию меди в свинце: 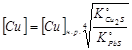 .
.
Пример 2. Задача о десульфуризации никеля с помощью магния решается аналогично задаче раскисления металла: 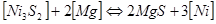 .
.
Упругость диссоциации 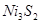 вычисляется по формуле:
вычисляется по формуле:  , где
, где 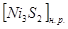 и
и  - растворимость и концентрация
- растворимость и концентрация 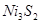 в никеле.
в никеле.
Упругость диссоциации 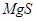 вычисляется по формуле:
вычисляется по формуле: 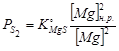 , где
, где 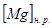 и
и 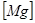 - растворимость и концентрация магния в никеле.
- растворимость и концентрация магния в никеле.
При установлении равновесия в конце десульфуризации давления 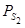 при диссоциации
при диссоциации 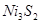 и
и 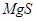 станут равными. Приравнивая эти величины, получим:
станут равными. Приравнивая эти величины, получим: 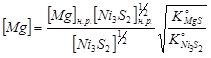
Теория осадительных плавок. При осадительных плавках металлом, обладающим большим сродством к сере, вытесняется из сульфидов металл, обладающий меньшим сродством к сере. При этом протекает реакция: 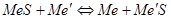 .
.
На практике процесс проводится с расплавами, т.е. в присутствии штейновой и металлической фаз. Обычно образуется еще третья фаза – шлаковая, образующаяся из компонентов пустой породы и флюсов. Равновесие между металлом и штейном при протекании реакции 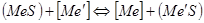 выразится уравнением:
выразится уравнением: 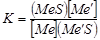 , при котором упругости диссоциаций обоих сульфидов равны:
, при котором упругости диссоциаций обоих сульфидов равны: 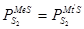
Здесь 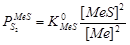 а
а 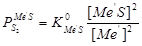 .
.
Если в процессе участвуют несколько сульфидов и металлов, то в равновесии они распределятся между штейновой и металлической фазами согласно соотношениям:
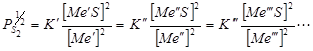
Коэффициенты 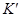 ;
; 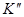 ;
; 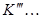 будут тем меньше, чем больше нормальное сродство металла к сере, чем меньше растворимость металла в металлической ванне больше растворимость сульфида в штейновой фазе при данной температуре (согласно уравнению
будут тем меньше, чем больше нормальное сродство металла к сере, чем меньше растворимость металла в металлической ванне больше растворимость сульфида в штейновой фазе при данной температуре (согласно уравнению  ).
).
Штейны. При плавке сульфидного сырья прочные низшие сульфиды металлов образуют сплав сульфидов – штейн. Жидкие штейны отличаются малой вязкостью и большой плотностью. Основная составляющая штейнов рудной плавки - сульфид железа - 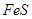 . Штейны называют по присутствующему в нем цветному металлу, извлечение которого является задачей плавки (медные, никелевые). Штейны восстановительных плавок содержат, кроме сульфидов свободные металлы, штейны окисленных плавок содержат до
. Штейны называют по присутствующему в нем цветному металлу, извлечение которого является задачей плавки (медные, никелевые). Штейны восстановительных плавок содержат, кроме сульфидов свободные металлы, штейны окисленных плавок содержат до  оксидов железа.
оксидов железа.
Штейны, с низким содержанием цветных металлов называются бедными, с высоким - богатыми. Высокое содержание кислорода встречается в бедных штейнах, т.к. растворимость в штейнах оксидов железа уменьшается с понижением в нём концентрации сульфида железа.
Штейн из почти чистого 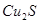 , называют файнштейном или «белым маттом»; штейн, состоящий из сульфида никеля, называется никелевым файнштейном. Общее описание штейновых систем дают диаграммы состояния сплавов из двух металлов и серы. В штейнах окислительных плавок присутствуют
, называют файнштейном или «белым маттом»; штейн, состоящий из сульфида никеля, называется никелевым файнштейном. Общее описание штейновых систем дают диаграммы состояния сплавов из двух металлов и серы. В штейнах окислительных плавок присутствуют 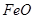 и
и 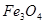 . Растворимость
. Растворимость 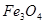 понижается с понижением температуры, т.ч. при охлаждении жидкого штейна происходит выделение кристаллов и повышение вязкости штейна, затрудняющее его отделение от шлака. Промышленные медные штейны наряду с кислородом содержат и другие сульфиды часто в значительных количествах. Значительное усложнение поведения медных штейнов вызывает
понижается с понижением температуры, т.ч. при охлаждении жидкого штейна происходит выделение кристаллов и повышение вязкости штейна, затрудняющее его отделение от шлака. Промышленные медные штейны наряду с кислородом содержат и другие сульфиды часто в значительных количествах. Значительное усложнение поведения медных штейнов вызывает 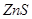 , содержание которого может достигать
, содержание которого может достигать 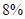 .
.
Штейны являются хорошими коллекторами благородных металлов. Концентрация благородных металлов в штейнах в сотни раз превышает концентрацию этих металлов в сосуществующих со штейнами шлаках. Потери благородных металлов при плавках на штейн пропорциональны механическим потерям штейна в шлаке.
Если при плавке наряду со штейном получается металлический продукт, то последний является еще более сильным коллектором благородных металлов, и основная масса этих металлов концентрируется в металлическом продукте.
Физико-химические основы процессов обжига и плавки сульфидов. Окисление сульфидов кислородом воздуха – необратимая экзотермическая реакция 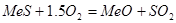 .
.
В газообразном состоянии сера может находиться в виде молекул 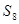 ;
;  ;
; 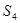 ;
; 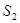 . При температуре
. При температуре 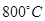 и выше (т.е. при температурах окислительного обжига) сера находится в основном в виде молекул
и выше (т.е. при температурах окислительного обжига) сера находится в основном в виде молекул 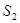 . В атомарном состоянии сера может находиться при температуре свыше
. В атомарном состоянии сера может находиться при температуре свыше 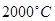 .
.
При нагревании в процессе обжига сульфиды диссоциируют с выделением в газовую фазу двухатомных молекул серы. В газовой фазе происходит окисление серы до  :
: 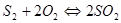 .
.
Кислород окисляет  до серного ангидрида по реакции:
до серного ангидрида по реакции:  ;
;  .
.
Окисление сульфида с получением МеО и  и последующее окисление
и последующее окисление  до
до 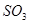 предоопределяют возможность образования.
предоопределяют возможность образования.
Реакция окисления  до
до 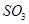 основная при получении серной кислоты контактным способом. Зависимость
основная при получении серной кислоты контактным способом. Зависимость 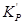 от Т может описывается уравнением:
от Т может описывается уравнением: 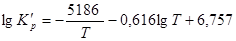 (Табл 1).
(Табл 1).
Таблица 1. Значения константы равновесия реакции образования 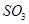
| Температура, K | |||||||
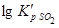
| 2.15·10-3 | 1.92·10-2 | 0.112 | 0.399 | 1.18 | 2.88 | 6.76 |
Значения 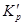 свидетельствуют о малой прочности
свидетельствуют о малой прочности 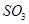 при высоких температурах.
при высоких температурах.
 Графически зависимость состава газовой фазы от температуры выразится в виде кривой (рисунок 6, 7). При низких температурах всё
Графически зависимость состава газовой фазы от температуры выразится в виде кривой (рисунок 6, 7). При низких температурах всё  при наличии в газах
при наличии в газах 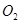 должно перейти в
должно перейти в 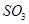 . Состав печных газов при обжиге сульфидов изменяется с изменением температуры из-за образования и разложения
. Состав печных газов при обжиге сульфидов изменяется с изменением температуры из-за образования и разложения 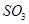 .
.
Если газ до начала образования 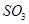 имел парциальное
имел парциальное 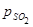 и
и 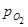 , то вследствие образования
, то вследствие образования 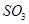 с давлением
с давлением  парциальные давления
парциальные давления  и
и 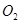 уменьшатся. Они станут равными
уменьшатся. Они станут равными 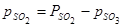 и
и 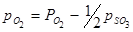 .
.
 В соответствии с правилом фаз невозможно весь
В соответствии с правилом фаз невозможно весь  превратить в
превратить в 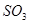 , в газовой фазе при любых температурах и давлениях присутствуют и
, в газовой фазе при любых температурах и давлениях присутствуют и 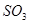 , и
, и  , и
, и 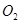 .
.
Необходимо отметить влияние давления на синтез 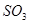 . Согласно правилу Ле-Шателье степень диссоциации
. Согласно правилу Ле-Шателье степень диссоциации 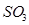 увеличивается при пониженных давлениях.
увеличивается при пониженных давлениях.
Обжиг сульфидов в избытке кислорода. При обжиге сульфидов в избытке кислорода протекают следующие реакции:
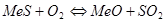 ,
, 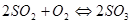 .
.
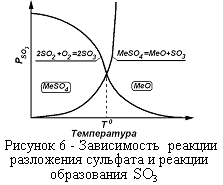
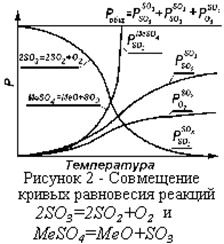
Присутствие в обжиговых газах SO3 приводит к образованию сульфатов (рисунок 2): MeO+SO3=MeSO4.
Образующиеся сульфаты устойчивы в окислительной атмосфере и могут перейти в конечный огарок. В одних случаях это нежелательно, если целью обжига является полное удаление серы, в других случаях – при - образование сульфатов полезно. Вопрос об условиях образования и разложения сульфатов может быть разрешен, если имеются термодинамические характеристики сульфатов. Характеристиками сульфатов служат величины ΔG0 образования сульфата по реакции: 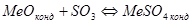 ;
; 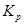 и
и 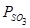 реакции. Диссоциация сульфата протекает согласно уравнению:
реакции. Диссоциация сульфата протекает согласно уравнению:  .
.
 Зависимость
Зависимость 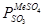 от температуры имеет экспоненциальный характер.
от температуры имеет экспоненциальный характер. 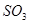 диссоциирует, на
диссоциирует, на  и
и 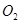 :
:  . Располагая характеристиками сульфата и составом печных газов (Рис. 2), можно решить вопрос о возможности образования сульфата. Образование сульфата возможно, если давление газообразного продукта диссоциации сульфата
. Располагая характеристиками сульфата и составом печных газов (Рис. 2), можно решить вопрос о возможности образования сульфата. Образование сульфата возможно, если давление газообразного продукта диссоциации сульфата 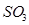 меньше, чем
меньше, чем 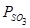 газовой фазы, т.е., сульфат образуется, если
газовой фазы, т.е., сульфат образуется, если  . Пересечение кривых
. Пересечение кривых 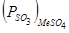 и
и 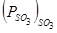 дают температуры, при которых сульфаты разлагаются. Образованию сульфатов благоприятствуют высокие давления и низкие температуры.
дают температуры, при которых сульфаты разлагаются. Образованию сульфатов благоприятствуют высокие давления и низкие температуры.
Суммарное давление газовой фазы при диссоциации сульфатов равно ΣР =  , которые на графиках представят серию экспонент. Температуру, при которой ΣР сульфата достигает величины 1 атм., называют температурой разложения сульфата. Температура разложения сульфата значительно ниже той, при которой
, которые на графиках представят серию экспонент. Температуру, при которой ΣР сульфата достигает величины 1 атм., называют температурой разложения сульфата. Температура разложения сульфата значительно ниже той, при которой 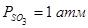 , т.к.
, т.к. 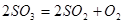 .
.
Чтобы представить себе общую картину образования и разложения сульфатов, рассмотрим зависимость ΔG0 образования сульфатов от температуры (рисунок 3).
 При окислительном обжиге концентратов (например, цинковых) в нем присутствуют примеси
При окислительном обжиге концентратов (например, цинковых) в нем присутствуют примеси 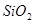 , Fe2O3 и т.д. Рассмотрим их влияние на образование сульфатов и их разложение. В присутствии SiO2 сульфат цинка диссоциирует согласно уравнению: 2ZnSO4+SiO2=2ZnO·SiO2+SO3.
, Fe2O3 и т.д. Рассмотрим их влияние на образование сульфатов и их разложение. В присутствии SiO2 сульфат цинка диссоциирует согласно уравнению: 2ZnSO4+SiO2=2ZnO·SiO2+SO3.
При протекании такой реакции 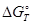 разложения при участии SiO2 меньше
разложения при участии SiO2 меньше 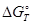 реакции разложения
реакции разложения  без его участия на величину
без его участия на величину 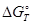 реакции образования 2ZnO·SiO2 Отсюда следует, что в присутствии SiO2 прочность
реакции образования 2ZnO·SiO2 Отсюда следует, что в присутствии SiO2 прочность  понижается.
понижается.
Для реакции:  , (
, ( ), а для реакции 2ZnSO4+SiO2=2ZnO·SiO2+SO3.
), а для реакции 2ZnSO4+SiO2=2ZnO·SiO2+SO3. 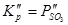 , и
, и  .
.
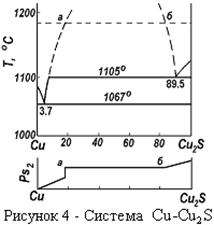
Графически это выражается следующим образом (рисунок 4).
Их данных рисунка 4 следует, что если в системе имеется 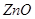 и 2ZnO·SiO2, то под воздействием
и 2ZnO·SiO2, то под воздействием 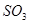 газовой фазы в первую очередь образуется сульфат цинка из
газовой фазы в первую очередь образуется сульфат цинка из 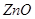 , а 2ZnO·SiO2 не будет образовывать сульфатов, пока не просульфатизирует весь
, а 2ZnO·SiO2 не будет образовывать сульфатов, пока не просульфатизирует весь 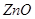 . Силикаты и ферриты цинка затрудняют образование сульфатов. Температура разложения сульфата считается, если сульфат разлагается в присутствии нелетучего кислотного оксида, образующего прочное химическое соединение с оксидом цинка.
. Силикаты и ферриты цинка затрудняют образование сульфатов. Температура разложения сульфата считается, если сульфат разлагается в присутствии нелетучего кислотного оксида, образующего прочное химическое соединение с оксидом цинка.
При разложении сульфатов образующиеся низшие оксиды металлов могут окисляться. Например, при диссоциации 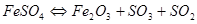
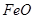 окисляется до
окисляется до 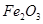 . Сульфат серебра диссоциирует по реакции
. Сульфат серебра диссоциирует по реакции 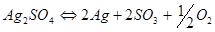 с одновременным разложением нестойкого окисла серебра
с одновременным разложением нестойкого окисла серебра 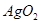 на компоненты. В этих случаях
на компоненты. В этих случаях 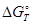 реакции не совпадают с
реакции не совпадают с 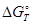 сульфата и должны быть рассчитаны с привлечением термодинамических функций, характеризующих новые продукты процесса.
сульфата и должны быть рассчитаны с привлечением термодинамических функций, характеризующих новые продукты процесса.
При обжиге нельзя избежать образования сульфатов, т.к. в определенной стадии обжига будут существовать условия, благоприятствующие сульфатизации. Если в продукте обжига не должно оставаться серы, то ранее образовавшиеся сульфаты должны быть разрушены повышением температуры. Если при обжиге температура повышается настолько, что  становится меньше
становится меньше  , то дальнейшее образование сульфата прекращается, а уже образовавшийся сульфат разлагается с выделением
, то дальнейшее образование сульфата прекращается, а уже образовавшийся сульфат разлагается с выделением 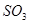 . Для полного разрушения сульфата необходимо поднять температуру настолько, чтобы давление газообразных продуктов диссоциации сульфат превысило внешнее давление.
. Для полного разрушения сульфата необходимо поднять температуру настолько, чтобы давление газообразных продуктов диссоциации сульфат превысило внешнее давление.
Кроме основных реакций окисления и сульфатообразования в процессе обжига может протекать целый ряд побочных процессов. Между сульфатом и сульфидом металла могут происходить реакции с образованием или оксида или металла:
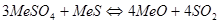
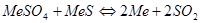
Однако, в присутствии избыточного количества кислород эти реакции не получают большого развития. Таким образом, при обжиге сульфидных материалов при избытке кислорода в газовой фазе возможно существование следующих компонентов:

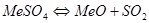
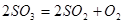
Обжиг сульфидов с недостатком кислорода. При обжиге сульфидов с недостатком кислорода могут протекать реакции:
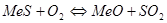
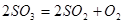
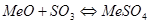
Но одновременно с этими реакциями значительное развитие могут получить вторичные реакции:
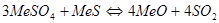
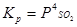
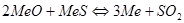
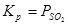
Значит при обжиге с недостатком кислорода возможность существование следующих фаз: 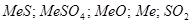 .
.
Разберем диаграмму парциальных давлений в системе MeS+O2 при недостатке О2 (рисунок 5). При низких температурах 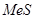 частично (т.к. недостаток кислорода) окисляется до
частично (т.к. недостаток кислорода) окисляется до 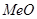 . Часть
. Часть 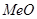 при низких температурах (т.к. созданы благоприятные условия) может перейти в сульфаты.
при низких температурах (т.к. созданы благоприятные условия) может перейти в сульфаты.
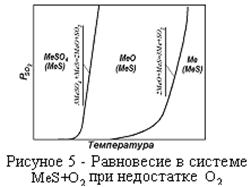 При повышении температуры
При повышении температуры 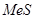 и
и 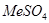 начинают взаимодействовать с образованием
начинают взаимодействовать с образованием 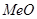 и
и  .Процесс пойдет до конца с образованием
.Процесс пойдет до конца с образованием 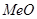 . В этих условиях устойчивыми фазами будут
. В этих условиях устойчивыми фазами будут 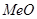 и
и 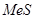 (т.к. недостаток кислорода). При повышении температуры начинается взаимодействие
(т.к. недостаток кислорода). При повышении температуры начинается взаимодействие 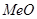 и
и 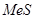 с образованием
с образованием 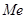 и
и  . Процесс идет
. Процесс идет
до полного исчезновения 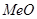 . Устойчивыми фазами являются
. Устойчивыми фазами являются 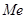 и
и 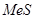 . Изменение
. Изменение 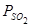 от температуры подчиняется закону экспоненты.
от температуры подчиняется закону экспоненты.
Взаимодействие между 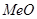 и
и 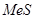 называется реакционной плавкой.
называется реакционной плавкой.
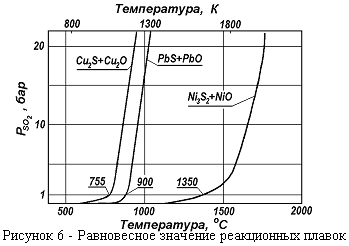
Реакционная плавка имеет очень большое значение в металлургии. На реакционной плавке основано получение свинца, меди. Процесс может проходить при низких и при высоких температурах, однако при низких температурах процесс протекает с небольшой, неприемлемой скоростью. При понижении давления процесс ускоряется. В вакууме реакционная плавка может идти быстро при низких температурах. Реакционной плавкой, теоретически, можно получить все металлы. Зависимость 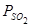 реакционной плавки для получения различных металлов приведена на рисунке 6. Невозможно получить реакционной плавкой никель, кобальт и железо, т.к. при высокой температуре они растворяют в себе много кислорода и серы.
реакционной плавки для получения различных металлов приведена на рисунке 6. Невозможно получить реакционной плавкой никель, кобальт и железо, т.к. при высокой температуре они растворяют в себе много кислорода и серы.
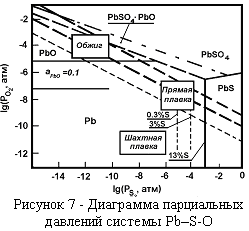
Диаграмма (рисунок 7) позволяет прогнозировать результаты переработки свинцовых сульфидных концентратов в условиях агломерирующего обжига, щахтной восстановительной плавки и в условиях автогенных плавок.
Горновая плавка. Реакционная плавка свинца основана на взаимодействии 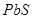 и
и 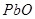 по реакции:
по реакции: 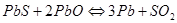 . Реакция эндотермическая, обратимая,
. Реакция эндотермическая, обратимая, 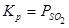 .
.
При температуре выше 850 ºС упругость  превышает
превышает 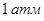 , чем обеспечивается протекание реакций в сторону образования свинца.
, чем обеспечивается протекание реакций в сторону образования свинца.
| |||||
|
Конвертирование медных штейнов. Процесс конвертирования медных штейнов сводится к следующему: при продувке штейна воздухом в конвертере в присутствии кварцевого флюса происходит интенсивное окисление сернистого железа с образованием FeO и SO2. FeO соединяется с SiO2 и образует шлак, а  выделяется в газы.
выделяется в газы.
Штейн и шлак имеют различные плотности и ограниченную взаимную растворимость, поэтому они разделяются. Шлак периодически сливают. Продувку продолжают до получения обогащенного штейна или белого штейна, содержащего не менее 75% меди и десятые доли процента железа.
Продукты первого периода конвертирования: белый штейн, шлак, отходящие газы и пыль.
Во втором периоде идет окисление полусернистой меди. Образующаяся при этом Сu2O во втором периоде интенсивно взаимодействует с полусернистой медью по реакции:
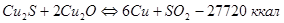
Продукты второго периода – черновая медь, в которой концентрируются благородные металлы.
Тепла эндотермических реакций окисления железа и серы штейна достаточно для ведения процесса без дополнительных затрат топлива.
Возможность протекания реакции вправо подтверждается данными равновесного давления сернистого газа 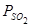 в зависимости от температуры.
в зависимости от температуры.
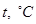
| ||||||

| 0,045 | 0,159 | 1,007 | 3,03 | 5,73 | 6,46 |
Более полное представление о поведении различных металлов в условиях окислительной атмосферы при различных температурах можно получить на основании анализа диаграмм фазовых равновесий систем Me-S-O (рис. 8, 9).

Взаимодействие между сульфидами и оксидами. Концентрационная плавка. Основной реакцией взаимодействия низших оксидов с низшими сульфидами является реакция взаимного обмена:  .
.
Если сульфиды и оксиды реагируют без образования растворов, то реакция протекает необратимо, и направление её определяется знаком изменения свободной энергии, вычисляемой как алгебраическая сумма свободных энергий образования веществ, участвующих в реакции, т.е.:  , или
, или 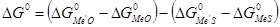 , или
, или 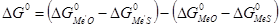 .
.
Если 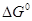 < 0, то реакция идет до конца вправо, т.е. до исчезновения одного из исходных веществ левой части. Если
< 0, то реакция идет до конца вправо, т.е. до исчезновения одного из исходных веществ левой части. Если  > 0, то реакция идет до конца влево (Рис. 10). Знак термодинамического потенциала определяется соотношением сродства металлов к сере и к кислороду. Выражая Δ G0 через упругости диссоциации (или константы равновесия) оксидов и сульфидов получим следующие уравнения:
> 0, то реакция идет до конца влево (Рис. 10). Знак термодинамического потенциала определяется соотношением сродства металлов к сере и к кислороду. Выражая Δ G0 через упругости диссоциации (или константы равновесия) оксидов и сульфидов получим следующие уравнения:
 ,
, 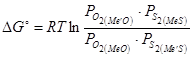
Если процесс проходит в расплавах, то необходимо учитывать изменение сродства в зависимости от концентрации.
Концентрационная плавка медных концентратов. Медные концентраты содержат 15-35% меди в виде 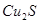 ,
, 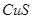 ,
, 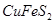 и пустую породу. Задача плавки сводится к получению медного штейна с повышенным по сравнению с сырьем содержанием меди.
и пустую породу. Задача плавки сводится к получению медного штейна с повышенным по сравнению с сырьем содержанием меди.
При плавке происходит диссоциация высших сульфидов:  ,
, 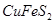 ,
, 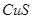 и горение сульфидов по реакции:
и горение сульфидов по реакции:
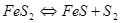
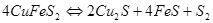
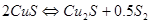
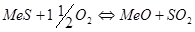
Неокислившиеся сульфиды образуют штейновую фазу 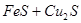 , а оксиды – шлаковую. Далее происходит взаимодействие между шлаковой и штейновой фазами, в основе которого лежит реакция:
, а оксиды – шлаковую. Далее происходит взаимодействие между шлаковой и штейновой фазами, в основе которого лежит реакция:
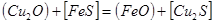
Медь практически полностью переходит в штейн, а железо распределяется между шлаком и штейном.
Железо обладает большим сродством к кислороду. Вследствие более высокого термодинамического потенциала образования FeO по сравнению с потенциалами образования Cu2O суммарный термодинамический потенциал реакции получается большим. Это указывает на то, что реакция должна проходить далеко вправо.
Концентрационная плавка никелевых окисленных руд на никелевый штейн. Никелевые окисленные руды, содержащие 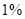 и даже менее никеля, перерабатывают на никелевый штейн, содержащий около
и даже менее никеля, перерабатывают на никелевый штейн, содержащий около 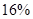 никеля. Источником серы служит подаваемый в печь пирит или гипс; в качестве топлива и восстановителя гипса применяют кокс.
никеля. Источником серы служит подаваемый в печь пирит или гипс; в качестве топлива и восстановителя гипса применяют кокс.
При плавке с гипсом его восстанавливают оксидом углерода, который образуется в печи за счет реакции Будуара. Восстановление гипса идет по реакции:
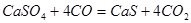
Затем происходит реакция:
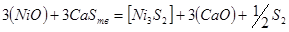
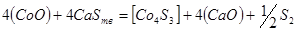
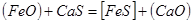
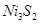 ,
,  ,
, 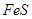 образуют штейн,
образуют штейн, 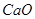 переходит в шлак, избыток серы газифицируется.
переходит в шлак, избыток серы газифицируется.
 образования
образования 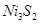 ,
,  и
и 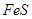 больше, чем
больше, чем  образования
образования 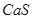 , поэтому идёт сульфидирование. В свою очередь,
, поэтому идёт сульфидирование. В свою очередь,  образования
образования 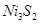 и
и  больше,
больше,  образования
образования 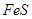 , поэтому сульфидирование
, поэтому сульфидирование 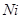 и
и 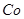 возможно при помощи
возможно при помощи 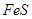 .
.
Если в шихту шахтной никелевой плавки в качестве сульфидизатора добавляют пирит, то сульфидирование никеля и кобальта будет происходить за счет образующегося 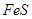 и паров серы.
и паров серы.
Равновесие между штейном и шлаком.
Взаимодействие между  и
и 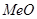 происходит по следующей реакции:
происходит по следующей реакции:
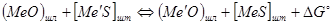
Реакция идет, как вам известно, только в сторону убыли термодинамического потенциала: 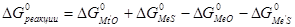
Если реакция идет в расплавах, то сродство элементов к кислороду и сере по мере прохождения реакции изменяется, и когда алгебраическая сумма всех ΔG0 компонентов реакции станет равной нулю, наступит равновесие, при котором 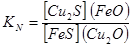 ;
; 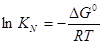 .
.
Величины сродства металла 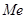 и
и 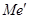 к
к 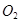 и
и 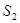 определяют направление реакции.
определяют направление реакции.
Пример. ΔG0 участников реакции FeS+Cu2O = Cu2S+FeO при 1000 ºС имеют следующие значения: 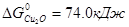 ,
, 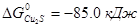 ,
, 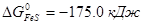 ,
, 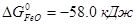 .
.
Σ  =(-85.0-58.0)-(74.0-175.0)=-42.0 кДж. Реакция пойдет до конца, т.к. при этой температуре все компоненты остаются в твердом состоянии.
=(-85.0-58.0)-(74.0-175.0)=-42.0 кДж. Реакция пойдет до конца, т.к. при этой температуре все компоненты остаются в твердом состоянии.
В расплавах при 1200 ºС эта реакция дойдет до равновесия и последнее будет сильно сдвинуто вправо 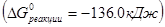 .
. 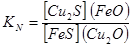 ;
;  ;
; 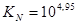
Т. е., медь концентрируется в штейне, а железо в шлаке.
Более удобно вычислять  следующим образом. Сначала вычислить для каждого металла разность между сродством к кислороду и сере, а затем определить разность между полученными результатами:
следующим образом. Сначала вычислить для каждого металла разность между сродством к кислороду и сере, а затем определить разность между полученными результатами:  .
.
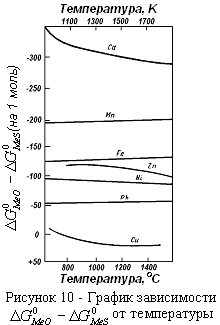
Графически можно изобразить эти величины для различных металлов в зависимости от температуры на одной диаграмме (рисунок 10). По диаграмме можно судить о распределении металлов между штейном и шлаком. Если взять пару медь и свинец, то диаграмма указывает, что свинец переходит в шлак, а медь в штейн. Пара никель и железо, взятые в виде окислов и сульфидов, будут реагировать таким образом, что никель, в основном, перейдет в штейн, а железо в шлак. Любой металл в паре с кальцием будет переходить в штейн, а кальций в шлак. Следовательно, нижерасположенные металлы переходят в штейн, вышерасположенные – в шлак.
Эта диаграмма дает возможность количественно по величине 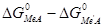 определить константу равновесия реакций взаимодействия сульфидов и оксидов.
определить константу равновесия реакций взаимодействия сульфидов и оксидов.
Поиск по сайту: