 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекция 3. Основы процессов испарения, возгонки, конденсации и сублимации
Явления испарения и конденсации имеют большое значение в пирометаллургии. При нагревании материалов в токе газов наблюдается испарение ценных летучих компонентов и унос их газами из рабочего пространства. Любое чистое вещество при каждой температуре имеет вполне определенное давление насыщенных паров. Зависимость давления насыщенного пара от температуры носит экспоненциальный характер. Прохождение температур фазовых или полиморфных превращений будет отмечено перегибами на кривой в возрастании давления (рисунок 1). При нагревании твердого вещества до температуры плавления мы имеем кривую равновесия однокомпонентной двухфазной системы: тверд  пар. После точки плавления получаем кривую равновесия однокомпонентной двухфазной системы жидкость
пар. После точки плавления получаем кривую равновесия однокомпонентной двухфазной системы жидкость  пар. Все точки, на кривой, принадлежат к равновесным состояниям системы.
пар. Все точки, на кривой, принадлежат к равновесным состояниям системы.
 Давление насыщенных паров металлов и их соединений в зависимости от температуры. Если точка расположена ниже равновесной кривой, т.е. в области ненасыщенного пара, т.е. давление паров над системой ниже равновесного, то будет происходить процесс испарения или возгонки пока давление в системе не достигнет равновесного. В области пересыщенного пара (выше кривой равновесного давления) должен протекать процесс конденсации (сублимации) понижающий давление пара под системой, до равновесного.
Давление насыщенных паров металлов и их соединений в зависимости от температуры. Если точка расположена ниже равновесной кривой, т.е. в области ненасыщенного пара, т.е. давление паров над системой ниже равновесного, то будет происходить процесс испарения или возгонки пока давление в системе не достигнет равновесного. В области пересыщенного пара (выше кривой равновесного давления) должен протекать процесс конденсации (сублимации) понижающий давление пара под системой, до равновесного.
Термодинамика процессов испарения в однокомпонентной системе. Термодинамика процессов испарения и сублимации описывается уравнением Клаузиуса–Клайперона:  (1), которое связывает в дифференциальной форме упругость пара
(1), которое связывает в дифференциальной форме упругость пара  , температуру в градусах Кельвина и величину молярной скрытой теплоты испарения (или сублимации) λ. Для малых значений упругости насыщенного пара λ может быть принята постоянной, тогда при интегрировании получим:
, температуру в градусах Кельвина и величину молярной скрытой теплоты испарения (или сублимации) λ. Для малых значений упругости насыщенного пара λ может быть принята постоянной, тогда при интегрировании получим:  (2), где А и В – постоянные. Эта формула пригодна для малых давлений пара и небольших интервалов температуры. Более точна и пригодна для более широкого интервала температур формула:
(2), где А и В – постоянные. Эта формула пригодна для малых давлений пара и небольших интервалов температуры. Более точна и пригодна для более широкого интервала температур формула:  (3). (Принято, что зависимость λ от температуры носит линейных характер и описывается уравнением: λ = аТ + В). Формулы 2 и 3 применяются, когда давление, темпе-ратура и объем пара подчиняются уравнению состояния идеальных газов:
(3). (Принято, что зависимость λ от температуры носит линейных характер и описывается уравнением: λ = аТ + В). Формулы 2 и 3 применяются, когда давление, темпе-ратура и объем пара подчиняются уравнению состояния идеальных газов: 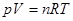 (5).
(5).
На рисунке 2 приведены графики зависимости равновесного давления пара некоторых металлов от температуры.
Наименьшей температурой кипения из металлов обладает ртуть - 356,8 °С; наибольшая температура кипения у вольфрама - ~ 5500 °С.
Металлы переходят в газ в атомарном состоянии, газы испаряются в виде молекул (O2, N2). Некоторые вещества, переходя в газообразное состояние, в зависимости от температуры изменяют свой состав. Например, сера, переходя в газообразное состояние, с повышением температуры претерпевает следующие изменения: Sтв ↔ Sж ↔ S82 ↔ S6 ↔ S4 ↔ S2 ↔ S. Соответственно это отразится на графике зависимости давления насыщенного пара серы от температуры.

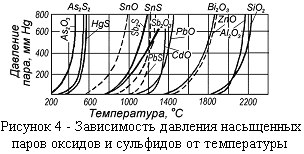
Оксиды, сульфиды и особенно хлориды ряда металлов имеют высокое равновесное давление (рисунки 4, 5), и это может оказывать принципиальное влияние при обосновании технологий переработки металлсодержащего сырья.

| 
|

При расчёте металлургических систем необходимо учитывать, что при повышении температуры помимо процессов испарения, могут протекать процессы диссоциации химических соединений, что может отразиться на давлении паров продуктов: МеА ↔ Ме + А. Общее давление газовой фазы будет равно сумме давлений составляющих её газов - недиссоциированных молекул плюс давление паров диссоциированных молекул: Робщ = РМеА + РМе + РА.
Кинетика процессов испарения. В процессах испарения следует различать 2 скорости.
1) Скорость, к которой повышается упругость пара с данной величины Рх до величины упругости насыщенных при данной температуре паров. Эту скорость, которую можно назвать скоростью насыщения, можно измерить количеством пара, образующегося в единицу времени в единице объема пространства под конденсированной фазой. Скорость насыщения зависит от величины испаряющей поверхности в единице объема пространства и от скорости образования паров с единицы поверхности конденсированной фазы.
2) Скорость, с которой образуются пары в пространстве под конденсированной фазой с единицы поверхности в единицу времени при данной температуре, и следует назвать скоростью испарения.
Для вычисления скорости испарения можно использовать формулу закона Дальтона:
 при Т = const
при Т = const
V – скорость испарения количества вещества, испаряемое с единицы поверхности в единицу времени.
H – внешнее давление.
P – упругость насыщающих паров при данной температуре.
Pфакт – упругость паров в пространстве в данный момент.
К – коэффициент пропорциональности.
Согласно этой формуле скорость испарения уменьшается прямо пропорционально разности упругостей (Р – Рфак т). При Рфакт > Р скорость будет отрицательна, будет проходить процесс конденсации, а не испарения.
Чем меньше внешнее давление H, тем больше скорость процесса испарения. Т.е. под вакуумом испарение будет проходить с наибольшей скоростью.
Расход тепла на процессы испарения и возгонки.
Общий расход тепла на процесс испарения складывается из следующих величин:
1) Тепло на нагрев вещества от температуры Т1 до точки кипения Тк;
2) Тепло на скрытую теплоту парообразования – λпар.;
3) Тепло на перегрев пара от температуры кипения до температуры Ткон.
Испарение в многокомпонентных системах. В двухкомпонентных системах могут быть 3 случая:
· компоненты обладают неограниченной взаимной растворимостью при данной температуре;
· компоненты обладают полной взаимной нерастворимостью (образуют смеси);
· компоненты частично растворяются друг в друге. Давление паров двойных смесей. Упругости насыщенного пара чистых компонентов обозначим
через РА и РВ, а парциальные давления этих компонентов в газовой фазе через pА и pВ. Молярные доли компонентов в жидкой фазе обозначим через хА и хВ, а в газовой фазе – уА и уВ. Общее давление газовой фазы – Р0. Тогда: хА + хВ = 1; уА + уВ = 1; pА + pВ = Р0.

| 
|
В системе состоящей из нерастворимых друг в друге компонентов, каждый из компонентов при испарении ведет себя так, как он бы вел себя в отсутствии другого компонента, то есть, pА и pВ равны РА и РВ соответственно. Молярные доли компонентов в равновесной газовойфазе:  и
и 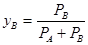 , определяются упругостями компонентов РА и РВ, т.е. температурой -
, определяются упругостями компонентов РА и РВ, т.е. температурой -  и не зависят от общего состава конденсированной части системы.
и не зависят от общего состава конденсированной части системы.
Давление пара А будет постоянным при всех концентрациях в смеси, за исключением чрезвычайно малых, когда давление пара А резко снижается до 0. То же имеет место для давления пара компонента В. Суммарное давление паров смеси складывается из давлений отдельных компонентов (А и В). Состав пара выразится как: 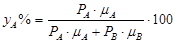 ;
; 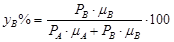 ;
; 
Графически состав пара от состава смеси изображается, исключая предельные значения, прямой линей (рисунок 7). Лишь в одной точке С состав жидкой фазы и состав паров одинаковы.

| 
|
Во всех же остальных случаях состав паров отличается от состава смеси. Для смесей с меньшим, чем в С, содержанием компонента А, пары более богаты компонентом А, чем смесь. Поэтому при дистилляции смесей двух компонентов при данной температуре всегда будет отгоняться пар одного и того же состава, не зависящий от состава смеси. Зависимости упругостей пара компонентов от температуры отразятся кривыми РА и РВ (рисунок 8). Из графика видно, что температура кипения смеси лежит ниже температуры кипения каждого из компонентов и не зависит от относительных количеств компонентов в конденсированной части системы.Эта особенность системы позволяет осуществить процесс перегонки труднокипящего вещества при температурах много ниже точки его кипения путем совместной его перегонки с нерастворимым в нем легкокипящим веществом. Разделение смеси возможно лишь в случае значительной разницы в упругостях паров обоих компонентов.
Упругость пара растворов при неограниченной растворимости. Для системы компонентов, образующих одну конденсированную фазу, согласно правилу фаз состав пара должен зависеть от состава конденсированной фазы. Зависимость между составами конденсированной и газовой фазы для систем, образующих идеальный раствор определяется законом Рауля: 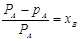 . Депрессия упругости пара растворителя равна молярной доле растворенного вещества. Заменяя в уравнении величину хВ на равную ей величину 1 - хА, получим:
. Депрессия упругости пара растворителя равна молярной доле растворенного вещества. Заменяя в уравнении величину хВ на равную ей величину 1 - хА, получим: 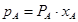 , а для другого компонента, считая на этот раз растворителем вещество В,
, а для другого компонента, считая на этот раз растворителем вещество В,  , или
, или  . Складывая pА и pВ, получим pА + pВ = РА·хА + РВ·(1 – хА). А т.к. pА + pВ = Р0, Подставив Р0 в уравнение, получим связь между
. Складывая pА и pВ, получим pА + pВ = РА·хА + РВ·(1 – хА). А т.к. pА + pВ = Р0, Подставив Р0 в уравнение, получим связь между  ,
,  и
и  , и составом конденсированной фазы в форме следующих соотношений: Р0 = РА·хА + РВ - РВ·хА и
, и составом конденсированной фазы в форме следующих соотношений: Р0 = РА·хА + РВ - РВ·хА и  . По этому выражению можно вычислить состав жидкой фазы, равновесной при любой Т, если известны давления насыщенного пара чистых компонентов, при заданной температуре и внешнем давлении Р0. Состав газовой фазы определяется из уравнения: pА = РА·хА делением его на величину общего давления пара Р0 = pА + pВ,, что дает для молярной доли вещества A и В в парах:
. По этому выражению можно вычислить состав жидкой фазы, равновесной при любой Т, если известны давления насыщенного пара чистых компонентов, при заданной температуре и внешнем давлении Р0. Состав газовой фазы определяется из уравнения: pА = РА·хА делением его на величину общего давления пара Р0 = pА + pВ,, что дает для молярной доли вещества A и В в парах: 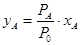 и
и  . На рисунке 9 нижняя кривая - «кривая жидкости» указывает составы жидкостей, равновесных с паром, а верхняя кривая – «кривая пара» указывает состав пара, равновесного с жидкостью.
. На рисунке 9 нижняя кривая - «кривая жидкости» указывает составы жидкостей, равновесных с паром, а верхняя кривая – «кривая пара» указывает состав пара, равновесного с жидкостью.
Две точки кривых соответствующих одной изотерме (yA – xA), указывают составы равновесных пара и жидкости. Из формы кривых видно, что температуры кипения идеальных растворов всегда лежат между температурами кипения чистых компонентов при том же давлении, а пар (точку уА) обогащен легкокипящим компонентом А по сравнению с равновесной жидкой фазой (точки хА). Если взаимное притяжение между различными молекулами раствора больше притяжения между одинаковыми молекулами, то образование раствора сопровождается выделением тепла, и возникают отрицательные отклонения от закона Рауля. Изотермы в этом случае криволинейны и лежат ниже изотерм идеального раствора (рисунок 10б).

| 
|
В системах с отрицательным отклонением от закона Рауля коэффициенты активности компонентов в растворе меньше единицы. Если взаимное притяжение между различными молекулами меньше, чем притяжение одинаковых молекул, то образование раствора сопровождается поглощениями тепла, и имеют место положительные отклонения от закона Рауля. При больших отклонениях от закона Рауля кривая кипения системы имеет максимум, в котором кривые жидкости и соприкасаются (рисунок 11 а, б). в) Отрицательные отклонения от закона Рауля характерны для систем компонентов, имеющих тенденцию к образованию химических соединений или непрерывного ряда твердых растворов. Жидкости, соответствующие точкам максимума и минимума кривых состояния жидкость-пар, при кипении не изменяют ни своего состава, ни температуры кипения; образующийся пар имеет тот же состав, что и жидкая фаза. Такие смеси называются азеотропными, при их испарении или конденсации частичное разделение компонентов не имеет места.
Упругость паров двухкомпонентных систем при ограниченной растворимости

|

|
Диаграммы с ограниченной растворимостью включают участки с полной взаимной растворимостью и участки с полной взаимной нерастворимостью компонентов друг в друге. Зависимость температуры кипения и состава паровой фазы для участков с полной взаимной растворимостью аналогична зависимости для систем с полной взаимной растворимостью. Зависимость температуры кипения и состава паровой фазы для участков с полной взаимной нерастворимостью аналогична зависимости для систем с полной взаимной нерастворимостью. На рисунке 12 приведены соответствующие диаграммы.
Фрагменты теории процессов конденсации. Перегретый пар из испарителя (рисунок 13) поступает в конденсатор.
Охлаждение перегретого пара при постоянном давлении делает его насыщенным, после чего должен идти процесс конденсации при постоянных температурах и давлении до полного перехода пара в жидкость. В перегретом паре нет жидкой фазы. Она образуется после значительного переохлаждения пара (рисунок 14, 15).
Объясняется это тем, что давление пара равновесного с жидкой фазой, зависит от кривизны поверхности раздела фаз, т.е. от размеров частиц жидкой фазы: чем меньше размер капель, тем больше равновесное давление сосуществующего с каплями пара. Повышение давления пара связано с существованием поверхностного натяжения жидкой фазы и выражается следующей формулой:  , где: Р0 – упругость пара, равновесное давление над плоской поверхностью жидкой фазы (при r = ∞), σ - поверхностное натяжение жидкости, М – молекулярная масса, α – плотность жидкости (г/м3), R – газовая постоянная, Т – температура, r – радиус жидкой капли (см), сосуществующей в равновесии с паром. Если паровая фаза представлена одним компонентом, то процесс конденсации может проходить при постоянной температуре, равновесной давлению пара, поступающего на конденсацию (рисунок 15). Процесс конденсации протекает без потерь конденсирующегося вещества.
, где: Р0 – упругость пара, равновесное давление над плоской поверхностью жидкой фазы (при r = ∞), σ - поверхностное натяжение жидкости, М – молекулярная масса, α – плотность жидкости (г/м3), R – газовая постоянная, Т – температура, r – радиус жидкой капли (см), сосуществующей в равновесии с паром. Если паровая фаза представлена одним компонентом, то процесс конденсации может проходить при постоянной температуре, равновесной давлению пара, поступающего на конденсацию (рисунок 15). Процесс конденсации протекает без потерь конденсирующегося вещества.


Процесса конденсации из парогазовой смеси рассмотрим на графике (рисунок 15, б). В конденсатор поступает смесь нагретого пара с начальным парциальным давлением Рисх и газа с парциальным давлением Рг, имеющая общее давление Робщ= Рисх+ Рг, остающееся неизменным во время процесса, текущего при постоянном давлении. Парогазовая смесь поступает в конденсатор с температурой Тисх, при которой начинается процесс конденсации, и затем охлаждается до конечной температуры конденсации – Ткк. При температуре Ткк несконденсировавшийся остаток газообразных веществ, сохраняя постоянным общее давление Робщ, уходит из конденсатора. Если конденсация заканчивается при температуре Тк.к. и при этой температуре газообразный остаток покидает конденсатор, то парциальное давление паров в этом остатке будет равно Рпк, равное упругости пара при температуре конца конденсации, а парциальное давление газов будет равно Робщ - Рпк, что вызовет потерю вещества вследствие неполноты его конденсации. Величина этих потерь может быть определена по формуле потери от неполноты конденсации:  , т.е. чем выше Рп.к ., тем больше потери.
, т.е. чем выше Рп.к ., тем больше потери.
Скорость конденсации. Следует различать скорости 2-х параллельно протекающих процессов: скорость появления центров конденсации; и скорость понижения упругости паров.
Для расчетов можно воспользоваться формулой Лэнгмюра:  , где: К – скорость конденсации (г/см2сек); Р – упругость насыщенного пара; Р1 – упругость пересыщенного пара.
, где: К – скорость конденсации (г/см2сек); Р – упругость насыщенного пара; Р1 – упругость пересыщенного пара.
Давление пара в тройных системах находятся экспериментально.
Дистилляционные методы получения металлов. С помощью дистилляционных методов получают целый ряд металлов - Zn, Hg, As.
Разделение алюминия от магния. Процесс основан на большой разности температур кипения Al и Mg – 2500 и 1107 оС соответственно. На рисунке 16 приведена зависимость упругости паров магния и алюминия от температуры. В системе Al – Mg (рисунок 17) образуется несколько твёрдых растворов.
Давление паров Mg в сплавах с Al при 600 оС находится в пределах 0.1- 0.7 мм Hg (рисунок 18). Равновесное давление паров алюминия при 600 оС равно 10-6 мм Hg. Разница в давлении паров позволяет проводить дистилляционное отделение магния от алюминия. Для увеличения скорости процесс ведут в вакууме.


Процесс отделения магния от алюминия ведут при температуре 600 оС.


Сплавы, содержащие 10-15 % магния, разделяют дистилляционными процессами при температуре 900 оС в вакууме. На рисунке 19 можно проследить зависимость равновесного давления пара магния от состава сплава с алюминием при 900 и 1107 оС. Однократной дистилляцией можно получить отрафинированный алюминий, содержащий 0.1- 0.2 % магния.
 Рафинирование латуни от меди. Латуни – это сплавы меди с цинком. Содержание цинка в сплавах - до 50 %. Разделение меди от цинка из латуни можно осуществить, так как эти металлы имеют разные точки кипения (tкип Zn = 907 о C, tкип Cu = 2600 оС).
Рафинирование латуни от меди. Латуни – это сплавы меди с цинком. Содержание цинка в сплавах - до 50 %. Разделение меди от цинка из латуни можно осуществить, так как эти металлы имеют разные точки кипения (tкип Zn = 907 о C, tкип Cu = 2600 оС).
В жидком состоянии Cu и Zn полностью взаиморастворимы, в твёрдом состоянии между ними образуется ряд твердых растворов. Зависимость давления паров от состава латуни над однородным жидким раствором и над двухфазными системами будет различной (рисунок 20). Процесс удаления Zn осуществляют однократной дистилляцией в электропечи, состоящей из испарителя и конденсатора в инертной атмосфере или в вакууме. При давлении газов в испарителе 10 мм Hg ст. «кипение» латуни будет проходить при температурах ниже 900 оС. Чтобы происходило кипение, надо нагреть латунь настолько, чтобы пары цинка могли преодолеть гидростатическое давление столба латуни.
Рафинирование свинца от цинка. Процесс проводят в стальном котле, в который помещают нагретый до 600 оС свинец, загрязненный цинком (рисунок 21). В жидкий металл опускают камеру, соединенную с вакуум–насосом. После создания вакуума начинается испарение цинка. Давление пара Zn над свинцом изменяется по мере испарения цинка. Над чистым цинком при 600 оС оно составляет 13 мм рт. ст. (рисунок 22). Для ускорения процесса испарения увеличивают площадь этой поверхности перекачиванием или перемешиванием жидкого свинца. Пары цинка конденсируются в виде кристаллов на внутренней поверхности крышки камеры, охлаждаемой водой. Этим методом можно отрафинировать свинец от цинка до десятых долей процента.

| 
|
Вельц-процесс применяется для возгонки цинка из кеков; шлаковозгоночный процесс - для возгонки Pb и Zn из шлаков свинцовой плавки.
Транспортные реакции
Дистилляция субгалоидов. Процесс получения сверхчистого алюминия основан на взаимодействии при высоких температурах алюминия с его галогенидами (AlF3, AlCl3) с образованием летучих соединений низшей валентности – субгалоидов (AlF; AlCl) и на последующем их распаде (при пониженных температурах) на алюминий и AlCl3.
AlF3 (г) + 2Al (ж) →3AlF (г) → 2Al (ж) + AlF3 (тв)
AlCl3 (г) + 2Al (ж) → 3AlCl (г) → 2Al (ж) + AlCl3 (г)
Иодидное рафинирование. Иодидное рафинирование заключается в обработке очищаемого технически чистого материала парами йода в вакууме. Образующийся летучий йодид металла разлагается при соприкосновении с накаленной проволочкой, на которой осаждается чистый плотный металл. Таким образом, процесс основан на обратимой реакции: Me + 2I2 ↔ MeI4
Ректификационное рафинирование. Для разделения металлов или их солей с близкими давлениями паров применяют метод многократной или дробной перегонки, называемой ректификацией.
Дробную перегонку осуществляют в ректификационных колоннах (рисунок 23). Колонна собирается из 35 – 40 тарелок. Каждая тарель устроена так, что позволяет парам металлов при нагревании подниматься, а жидкости сливаться вниз после того, как она переполнит тарелку. Таким образом, на каждой тарелке при определенной температуре жидкость на некоторое время задерживается и создается состояние, близкое к равновесному для жидкости и ее пара. Ректификационная колонна нагревается снизу; значит, чем выше расположена тарелка, тем меньше она нагревается, тем ниже температура ее рабочего пространства. На определенной тарелке при температуре t равновесные для данной температуры пары поднимаются на вышележащую тарелку, частично конденсируются. Конденсат стекает на нижележащую тарелку, где часть его снова переходит в пар определенного состава, равновесного для температуры на данной тарелке. Этот пар снова частично конденсируется на верхней тарелке и т.д. С каждой тарелки поднимается пар, обогащенный более летучим компонентом, и стекает жидкость, обогащенная менее летучим компонентом. Парообразная фаза, постепенно изменяя свой состав, попадает в конденсатор, а жидкая выливается из нижней, наиболее нагретой части колонки.

| 
|
Ректификационное разделение системы TiCl4 – SiCl4. Получение титана включает операцию хлорирования титансодержащего сырья. Процесс хлорирования описывается уравнением:
TiO2 + 2Cl2 + 2C = TiCl4↑ + 2CO.
В результате хлорирования, титан в форме тетрахлорида титана переходит в газовую фазу, из которой затем конденсируется, отделяясь от неконденсирующегося СО. В исходном сырье (титанистых шлаках или в природном концентрате) содержится некоторое количество кремнезёма, который при хлорировании образует тетрахлорид кремния SiCl4. Тетрахлорид кремния испаряется, и вместе с тетрахлоридом титана поступает в конденсатор и конденсируется. Для получения чистого тетрахлорида титана его надо отделить от тетрахлорида кремния. Разделение проводят процессом ректификации.
Улетучивание металлов, оксидов и сульфидов при плавке руд и концентратов. Улетучивание оксидов и сульфидов металлов при металлургических плавках является побочным процессом, обуславливающим или потери металлов при плавке, или удаление из шихты примесей. Например, при свинцовой восстановительной плавке наблюдается улетучивание свинца как в форме PbS, так и главным образом в форме PbO и отчасти Pb. При оловянной плавке наблюдается весьма заметное улетучивание и SnS, и SnO, и Sn. Можно указать целый ряд процессов, в которых улетучиваются Sb и As: медная плавка на штейн - это бессемерование медного штейна, окислительное рафинирование чернового свинца и т.д.
Улетучивание главных компонентов плавки (например, Pb при шахтной плавке) ведет к потерям Pb. Улетучивание же примесей As и Sb – помогает сконцентрировать эти металлы в одном из продуктов плавки – в возгонах.
При теоретических анализах улетучивания металлов при плавке необходимо учитывать, что в реальных процессах мы имеем дело с многокомпонентными расплавами, поведение в которых отдельных компонентов резко отличается от их поведения в чистом виде.
Поиск по сайту: