 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Осмотическое давление растворов
Явление осмоса (от греч. osmos - толчок, удар) впервые наблюдал А. Нолле, помещая водный раствор сахара в стеклянной, закрытой снизу полупроницаемой перепонкой трубке в сосуд с чистой водой. Вода, проникая через перепонку, вызывала подъем уровня раствора в трубке (рис. 7.3).
Для предотвращения проникновения растворителя в раствор над раствором нужно создать избыточное давление (Р’), называемое осмотическим.
| Рис. 7.3. Схема опыта А. Нолле: 1 - трубка с раствором сахара; 2 - сосуд с водой; 3 - полупроницаемая перепонка. |
Проявления осмотического давления весьма разносторонние. Например, типичные клетки живых организмов, образованные протоплазменной оболочкой, заполненной водным раствором различных веществ, испытывает осмотическое давление со стороны чистой воды в пределах от 4 до 20  105 Па. Поэтому обнаженные ткани (раневые поверхности) следует промывать не чистой водой, а физиологическим раствором с осмотическим давлением по отношению к клеточному раствору близкому к нулю. Это предохраняет клетки от набухания и разрушения.
105 Па. Поэтому обнаженные ткани (раневые поверхности) следует промывать не чистой водой, а физиологическим раствором с осмотическим давлением по отношению к клеточному раствору близкому к нулю. Это предохраняет клетки от набухания и разрушения.
В классической работе Вант-Гоффа (1886 г.) установлена связь осмотического давления с другими свойствами растворов.
Пусть раствор отделен от чистого растворителя полупроницаемой перегородкой (мембраной), способной перемещаться и пусть количество раствора так велико, что прибавление к нему или отнятие от него 1 моля растворителя не изменяет заметным образом его состав. Можно двумя путями перевести обратимо и изотермически 1 моль растворителя из чистого растворителя в раствор.
I путь. Испарение 1 моля растворителя из чистого растворителя при давлении его насыщенного пара Р0, расширение его до давления Р над раствором и конденсация под этим давлением в раствор.
Согласно (1.18) величина совершенной работы:
 . (7.15)
. (7.15)
Следует иметь в виду, что работы испарения и конденсации равны по величине, но противоположны по знаку, поэтому не учитываются.
II путь. Перемещение мембраны в растворитель на столько, пока сквозь нее в раствор не перейдет объем растворителя, отвечающий 1 молю его в газообразном состоянии. При этом, в соответствии с (1.11) совершается работа:
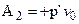 , (7.16)
, (7.16)
где р’ - осмотическое давление;
v 0 - молярный объем растворителя.
Так как А1 = А2, то 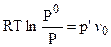 , откуда:
, откуда:
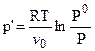 . (7.17)
. (7.17)
Это соотношение позволяет рассчитывать осмотическое давление для любых, в том числе и реальных растворов.
Для случая разбавленных растворов: 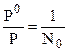 и
и 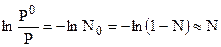 . Мольная доля растворенного вещества может быть рассчитана следующим образом:
. Мольная доля растворенного вещества может быть рассчитана следующим образом:
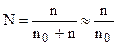 , (7.18)
, (7.18)
где n - количество растворенного вещества;
n0 - количество растворителя.
Тогда:
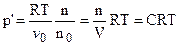 , (7.19)
, (7.19)
где V = v 0n0 - объем раствора;
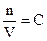 - концентрация раствора.
- концентрация раствора.
Соотношение (7.19) называется уравнением Вант-Гоффа. Из него следует, что осмотическое давление разбавленных растворов равно такому давлению, которое оказывало бы при данной температуре растворенное вещество, находясь в газообразном состоянии и занимая объем раствора.
Поиск по сайту: