 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Термодинамических процессов
Из определения функции "работа" следует, что она не является функцией состояния и ее величина зависит от того, в каких условиях она совершается.
Изобарический процесс (p = const).
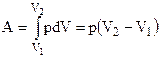 ,
,
где 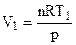 , а
, а 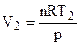 .
.
Тогда
 , (1.17)
, (1.17)
т. е. работа совершается при увеличении температуры системы.
Изотермический процесс (Т = const).
 ,
,
где 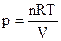 ,
,
тогда
 . (1.18)
. (1.18)
Изобарно-изотермический процесс (Р, Т = const).
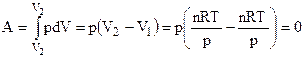 ,
,
т. е. в системе с неизменным количеством вещества такой процесс невозможен.
Если n1 - количество вещества в системе до реакции, а n2 - количество вещества в системе после реакции, то
 , (1.19)
, (1.19)
где  - изменение количества вещества в системе за счет химической реакции.
- изменение количества вещества в системе за счет химической реакции.
Адиабатический процесс.
Адиабатический процесс характеризуется отсутствием энергообмена в форме теплоты с окружающей средой, что определяется математически в виде условия  .
.
В этом случае уравнение первого начала принимает вид:
 , (1.20)
, (1.20)
где
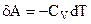 . (1.21)
. (1.21)
Тогда величина работы:
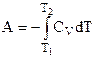 , (1.21)
, (1.21)
где СV - изохорическая теплоемкость системы, которая тем больше, чем сложнее устройство
молекул.
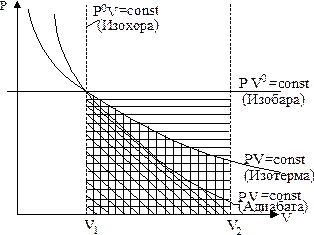
Рис. 1.1. Графическое изображение работы
расширения идеального газа от объема
V1 до объема V2 при различных условиях.
Графическая иллюстрация величины работы расширения идеального газа при изменении его объема от V1 до V2 при изотермическом, изохорическом, изобарическом и адиабатическом процессах представлена на рис. 1.1.
Из рис. 1.1 очевидно, что наибольшей является работа при Р = const и наименьшей - при  . Работа расширения равна нулю, если объем газа не изменяется (V = const). То же самое наблюдается и для работы сжатия с той лишь разницей, что ее величина будет отрицательной.
. Работа расширения равна нулю, если объем газа не изменяется (V = const). То же самое наблюдается и для работы сжатия с той лишь разницей, что ее величина будет отрицательной.
Поиск по сайту: