 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Термическая диссоциация
|
Читайте также: |
Многие вещества, нагревом переведенные в газообразное состояние при последующем повышении температуры разлагаются, причем степень их разложения увеличивается с повышением температуры, например:
I2  2I, H2
2I, H2  2H, PCl5
2H, PCl5  PCl3 + Cl2
PCl3 + Cl2
Количественно состояние диссоциирующего вещества характеризуется степенью диссоциации ( ), которая представляет собой отношение числа распавшихся молекул к числу молекул до распада. Очевидно, что 0
), которая представляет собой отношение числа распавшихся молекул к числу молекул до распада. Очевидно, что 0  1.
1.
Отношение общего числа частиц после диссоциации к числу молекул до диссоциации называется коэффициентом диссоциации (i). Для установления связи  и i необходимо задаться числом молекул до распада (n) и степенью их диссоциации
и i необходимо задаться числом молекул до распада (n) и степенью их диссоциации  . Если каждая молекула распадается на (m) частиц, то число вновь образовавшихся частиц составит величину m
. Если каждая молекула распадается на (m) частиц, то число вновь образовавшихся частиц составит величину m  n. Число нераспавшихся молекул равно n - n
n. Число нераспавшихся молекул равно n - n  . Тогда всего стало n - n
. Тогда всего стало n - n  + mn
+ mn  частиц.
частиц.
Следовательно величина i определяется:

или
 . (4.101)
. (4.101)
Таким образом  , причем m может принимать различные значения в зависимости от вида химической реакции, например:
, причем m может принимать различные значения в зависимости от вида химической реакции, например:
I2  2I, m =2;
2I, m =2;
PCl5  PCl3 + Cl2, m=2;
PCl3 + Cl2, m=2;
2NO2  2NO + O2, m=1,5 и т. д.
2NO + O2, m=1,5 и т. д.
С другой стороны, значение коэффициента диссоциации рассчитывается из соотношения:
 , (4.102)
, (4.102)
где М - теоретическая молекулярная масса вещества;
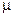 - опытная молекулярная масса вещества (она меньше теоретической по причине диссоциации вещества).
- опытная молекулярная масса вещества (она меньше теоретической по причине диссоциации вещества).
Таким образом, по аномалии молекулярной массы можно определять коэффициент диссоциации, что позволяет определить значение константы равновесия реакции диссоциации. Но при этом следует учитывать, что в каждом кокретном случае связь константы равновесия и степени диссоциации будет различной.
Наиболее простой случай диссоциации:
Cl2  Cl + Cl
Cl + Cl
n 0 0 - начальные количества вещества
n - n  n
n  n
n  - равновесные количества вещества
- равновесные количества вещества
Сумма количеств молей реагентов в состоянии равновесия:
 .
.
Тогда значения равновесных парциальных давлений реагентов в состоянии равновесия:
 ,
,
 ,
,
откуда
 .
.
В случае диссоциации водяного пара:
2Н2О = 2Н2 + О2
n 0 0 - начальные количества вещества
n - n  n
n 
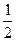 n
n  - равновесные количества вещества
- равновесные количества вещества
Общее количество вещества в равновесии:

Тогда парциальные давления Н2О, Н2 и О2 составят:
 ,
,
 ,
,
 .
.
Поэтому:
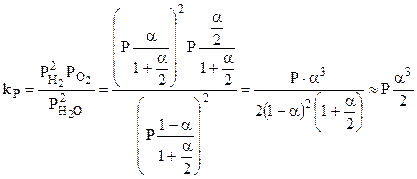 ,
,
если  малая величина.
малая величина.
Поиск по сайту: