 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Закон Гесса
В основе термохимии лежит закон, согласно которому тепловой эффект реакции не зависит от пути этой реакции, а определяется видом и состоянием исходных и конечных продуктов реакции.
Гесс Герман Иванович (1802 – 1850 г. г.) – русский химик, академик Петербуржской Академии наук.
Существо закона вытекает из уравнения первого начала термодинамики:
QV = -  V, а QP = -
V, а QP = -  H.
H.
U и Н – функции состояния, поэтому QV и QP также функции состояния системы.
Иллюстрация закона Гесса.
C + O2 = CO2 + Q1, (3.13)
есть первый вариант реакции в системе.
C + 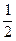 O2 = CO + Q2,
O2 = CO + Q2,
CО + 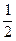 O2 = CO2 + Q3, (3.14)
O2 = CO2 + Q3, (3.14)
второй возможный вариант реакции.
Так из одинакового исходного состояния образуется одинаковое для рассмотренных вариантов конечное состояние, то:
Q1 = Q2 + Q3. (3.15)
Закон Гесса имеет огромное практическое значение. С его помощью устанавливаются значения тепловых эффектов реакций, экспериментальное определение которых затруднительно.
Для этих целей широко используются следствия из закона Гесса.
Поиск по сайту: