 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Рабинович, О.Н. Сборник задач по технической термодинамике: учеб. пособие / О.Н. Рабинович. -М.: 1973. - 393 с
Интернет – ресурсы
1. http://twt.mpei.ac.ru/ochkov/VPU_Book_New/mas/index.html (Расчетный сервер МЭИ)
2. http://twtmas.mpei.ac.ru/mas/Worksheets/h_s_Exp.mcd (Расчет параметров воды и перегретого пара по заданным р и t для цикла Ренкина)
3. http://twtmas.mpei.ac.ru/mas/Worksheets/wsp_PS.mcd (Расчет параметров точки 2 по известным р2 и s2=s1)
4. http://measure.newmail.ru (программа расчета параметров воды и пара).
Приложение А
Форма титульного листа РГР

Приложение Б
Форма задания на РГР
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное общеобразовательное учреждение
высшего профессионального образования
«Тамбовский государственный технический университет»
2013/2014 учебный год
Кафедра «Энергообеспечение предприятий и теплотехника»
Задание
на расчетно-графическую работу по дисциплине
«Техническая термодинамика»
Группа _____ БТЭ-21 _______
Студент ___ Сидоров И.А. ________________
Дата выдачи задания ____ сентября 2014 г.
Дата защиты 20 декабря 2014 г.
Содержание задания
Решить следующие задачи, принимая числовые данные из приведенных таблиц 1 ¸ 6 и сопровождая решение лаконичными пояснениями и необходимым графическим материалом.
|
Приложение В
Пример оформления решения задач
| Задача 1. Вариант 12. Исходные данные R =287 Дж/(кг×К); k =1,4; р 1=0,2 МПа; V 1=3,0 м3 ; t 1=40 оС; b=2,5; p 3=3,0 МПа. |
Решение задачи.
1. Рассчитываем недостающие параметры состояния для всех характерных точек.
Находим объём V 2 в точке 2
 Рис. 1. Задача 1 Рис. 1. Задача 1
|
V 2= V 1×b=3,0×2,5=7,5 м3.
и температуру Т 2, используя для изобарного процесса закон Гей-Люссака:
Т 2= Т 1×b=(40+273) ×2,5=782,5 К.
Находим объем в точке 3, учитывая, что процесс адиабатный и р 2= р 1:
 м3.
м3.
Находим температуру в точке 3:

Учитывая, что объем V 4= V 2 по известному соотношению, находим давление в точке 4:
 МПа.
МПа.
2. Рассчитываем массу т газа, используя уравнение состояния для идеальных газов:
 кг.
кг.
3. Рассчитываем работу и теплоту в каждом процессе.
Процесс 1 -2 - изобарный.
L 1-2= p 1,2(V 2- V 1)=0,2×106×(7,5-3,0)=0,9×106 Дж=900 кДж.
Q 1-2= m × cpm (T 2 - T 1) (1)×
где величину cpm рассчитываем по линейной зависимости срm = f (t) для воздуха [2]:
cpm =0,9952+0,00009349×(t 1+ t 2)=0,9952+0,00009349×[(40+273)+783,5]=1,054 кДж/(кг×К).
Для сравнения рассчитаем приближенное значение срm по средним мольным теплоемкостям для двухатомных газов
срm = m ср /m=29,31/28,96=1,012 кДж/(кг×К).
Сопоставляя результаты, отмечаем, что они совпадают с погрешностью не более 4¸5 %. Поэтому в последующих расчетах будем использовать величину срm = 1,012 кДж/(кг×К).
По формуле (1) рассчитываем
Q 1-2=6,68×1,012×[782,5-(40+273)]=3136 кДж.
Процесс 2 – 3 адиабатный.

Q 2-3=0.
Процесс 3 - 4 изотермический.

4. Проверяем правильность наших расчетов, вычисляя теплоемкость сvm = срm-R= 1,012-0,287=0,725 кДж/(кг×К) и вычисляя величину D U для процесса 1 – 2:
D U 1-2 = m сvm (T 2- T 1)=6,68×0,725(782,5-313)=2273,8 кДж.
По первому закону термодинамики D U 1-2 = Q 1-2- L 1-2=3136-900=2236 кДж. Сопоставление приведенных результатов показывает их хорошее совпадение (»2%).
Приложение Г
Таблица состояний воды и насыщенного водяного пара на линии насыщения (по температурам)
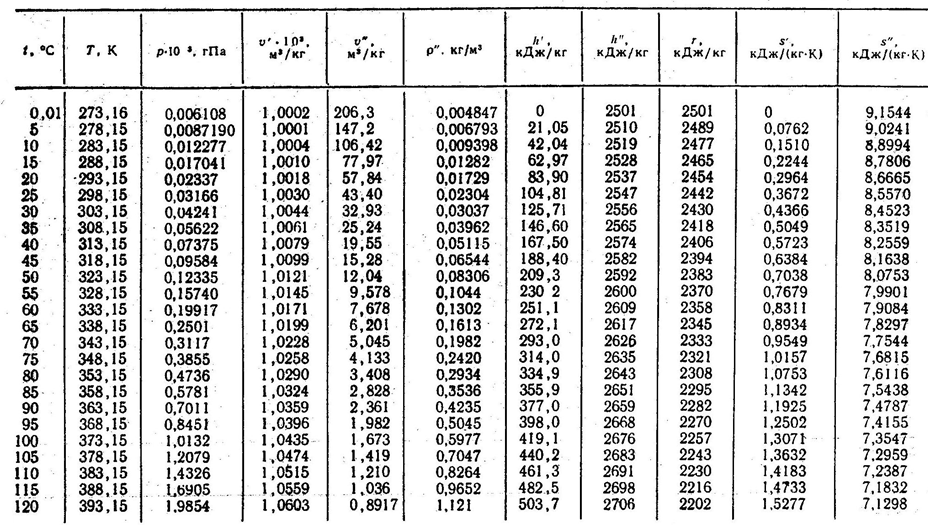
Продолжение 1 таблицы Г
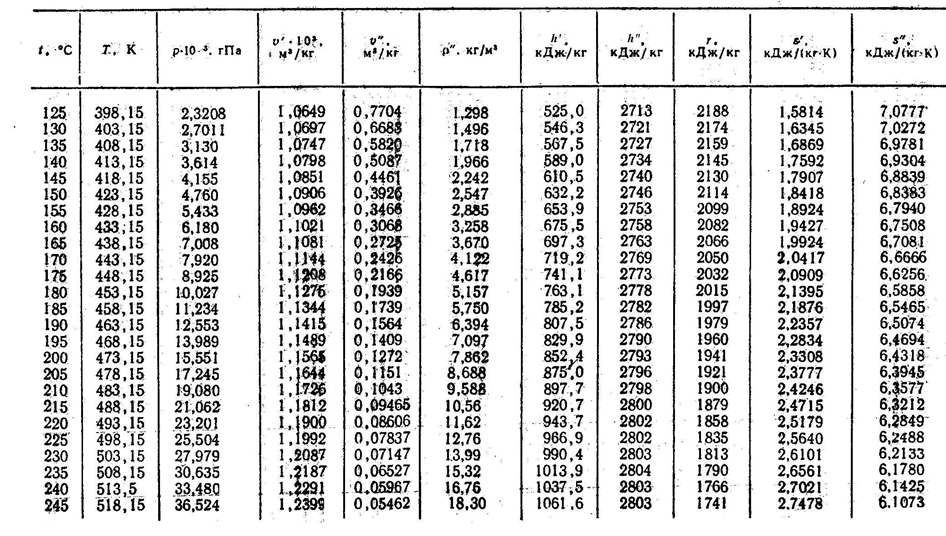
Продолжение 2 таблицы Г

Параметры критического состояния: t кр=374,15 оС, р кр=22,129 МПа, v кр=0,00326 м3/кг.
Поиск по сайту: