 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Примеры решения задач. Задача 1 Смесь азота и гелия при температуре 27 0С находится под давлением р=1,3×102 Па
Задача 1 Смесь азота и гелия при температуре 27 0С находится под давлением р=1,3×102 Па. Масса азота составляет 70 % от общей массы смеси. Найти концентрацию молекул каждого из газов.
Дано:
| T = 300 К p = 1,3×102 Па M1 = 0,7 M | Решение При данном давлении газ можно считать идеальным. Согласно основному уравнению молекулярно-кинетической теории: р=nkT, откуда n=p/kT. С одной стороны, масса каждого из газов: M1=c1M, (1) |
| n1 -? n2 -? |
M2=c2M,
где M - масса смеси; с1 и с2 – процентное содержание азота и гелия. С другой стороны, масса каждого из газов:
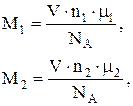 (2)
(2)
где V – объем газа; m – молярная масса газа; mi/NА – масса молекулы.
Приравнивая правые части уравнений (1) и (2), получим:
c1M=  ; c2M=
; c2M=  ;
;
откуда n1/n2= 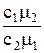 =1/3. Так как n1+n2=n, то
=1/3. Так как n1+n2=n, то
n1= 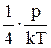 =0,8×1022 м-3, n2=
=0,8×1022 м-3, n2=  =2,4×1022 м-3.
=2,4×1022 м-3.
Ответ: n1= 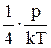 =0,8×1022 м-3, n2=
=0,8×1022 м-3, n2=  =2,4×1022 м-3.
=2,4×1022 м-3.
Задача 2 Найти среднюю квадратичную скорость, среднюю кинетическую энергию поступательного движения и среднюю полную кинетическую энергию молекул азота и гелия при температуре 27 0С. Определить полную энергию всех молекул 100 г каждого из газов.
Дано:
| T = 300 К M1 = 0,1 кг mНе = 4×10-3 кг/моль mN2 = 28×10-3 кг/моль | Решение
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
<Е>= 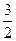 kT.
<E>=6,2×10-21 Дж, причем средние энергии поступательного движения одной молекулы азота и гелия одинаковы.
Средняя квадратичная скорость молекул газа зависит от массы его молекул: kT.
<E>=6,2×10-21 Дж, причем средние энергии поступательного движения одной молекулы азота и гелия одинаковы.
Средняя квадратичная скорость молекул газа зависит от массы его молекул:
|
| <uкв> -? E -? W -? |
<uкв>= 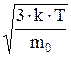 . (1)
. (1)
Для расчета средней квадратичной скорости выражение (1) удобно преобразовать, умножив числитель и знаменатель на NA:
<uкв>=  ;
;
<uкв>=13,7×102 м/с – для гелия; <uкв>=5,17×102 м/с – для азота.
Средняя полная энергия молекулы зависит от числа степеней свободы молекулы:
<E0>= 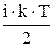 .
.
Полная кинетическая энергия всех молекул, равная для идеального газа его внутренней энергии, может быть найдена как произведение Е0 на число всех молекул:
Е=U=Е0×N; N= 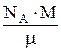 .
.
Гелий – одноатомный газ Þ i=3, тогда <E0>=6,2×10-21 Дж.
Азот – двухатомный газ Þ i=5, тогда <E0>=10,4×10-21 Дж.
Полная энергия всех молекул
W= 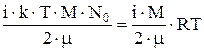 .
.
Для гелия W=93,5×103 Дж; для азота W=22,3×103 Дж.
Ответ: для гелия W=93,5×103 Дж; для азота W=22,3×103 Дж.
Задача 3 Рассчитать среднюю длину свободного пробега молекул азота, коэффициент диффузии и вязкость при давлении р=105 Па и температуре 17 0С. Как изменятся найденные величины в результате двукратного увеличения объема газа: 1) при постоянном давлении; 2) при постоянной температуре? Эффективный диаметр молекул азота d=3,7×10-8см.
| p = 105Па T = 300К V2 = 2V1 1) p – const 2) T – const d = 3,7×10-10 м | Решение
Средняя длина свободного пробега и коэффициенты переноса могут быть рассчитаны по следующим формулам:
 ; (1) ; (1)
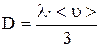 ; (2) ; (2)
|
| l -? D -? h -? |
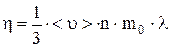 , (3)
, (3)
где n – концентрация молекул газа; <u> – средняя скорость молекулы; m0 – масса одной молекулы.
Концентрацию молекул можно определить из уравнения p=nkT:
n=p/kT подставим в уравнение (1):
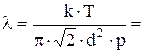 6,5×10-8 м.
6,5×10-8 м.
Средняя скорость <u>= 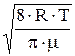 =470 м/с,
=470 м/с,
тогда D=1×10-5 м2/с.
Для расчета h подставим (1) в (3):
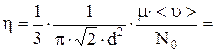 1,2×10-5
1,2×10-5 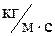 .
.
Как видно из выражения (1), длина свободного пробега зависит только от концентрации молекул. При двукратном увеличении объема концентрация уменьшится вдвое. Следовательно, при любом процессе l2/l1=2.
В выражение для коэффициента диффузии входит не только длина свободного пробега, но и средняя скорость. Тогда
 .
.
При р=const объем прямо пропорционален температуре: Т2/Т1=V2/V1=2, тогда D2/D1= 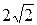 .
.
При Т=const D2/D1=l2/l1=2.
Вязкость зависит от скорости молекул, следовательно, и от температуры, т.е.
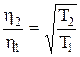 ,
,
при р=const 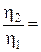
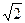 ;
;
при Т=const 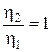 .
.
Ответ: l=6,5×10-8 м; D=1×10-5 м2/с; h=1,2×10-5 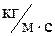 .
.
Задача 4 Пылинки массой 10-18 г взвешены в воздухе. Определить толщину слоя воздуха, в пределах которого концентрация пылинок различается не более чем на 1%. Температура воздуха во всем объеме одинакова: Т=300 К.
Дано:
m1 = 10-21 кг
T = 300 К
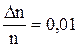
| Решение При равновесном распределении пылинок их концентрация зависит только от координаты z по оси, направленной вертикально. По распределению Больцмана: n=n0×e-u/kT=n0×e-mgz/kT. (1) Дифференцируя выражение (1) по z, получим |
| DZ -? |
dn=-n0× 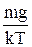 ×e-mgz/kT×dz.
×e-mgz/kT×dz.
Так как n0×e-mgz/kT=n, то dn= 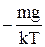 ×n×dz. Отсюда
×n×dz. Отсюда  .
.
Знак «-» показывает, что положительным изменениям координаты (dz>0) соответствует уменьшение относительной концентрации (dn<0). Знак «-» опускаем и заменяем dz и dn конечными приращениями Dz и Dn:
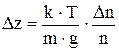 .
.
Dn/n=0,01 по условию задачи. Подставляя значения, получим Dz=4,23 мм.
Ответ: Dz=4,23 мм.
Задача 5 Вычислить удельные теплоемкости сv и сp смеси неона и водорода. Массовые доли газов w1=0,8 и w2=0,2. Значения удельных теплоемкостей газов – неон: сv=6,24  ; cp=1,04
; cp=1,04  ; водород: сv=10,4
; водород: сv=10,4  ; сp=14,6
; сp=14,6  .
.
Дано:
| w1 = 0,8 w2 = 0,2 cV1 = 6,24 кДж/кг × К cp1 = 1,04 кДж/кг × К cV2 = 10,4 кДж/кг × К cp2 = 14,6 кДж/кг × К | Решение
Теплоту, необходимую для нагревания смеси на DТ, выразим двумя соотношениями:
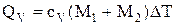 , (1)
где сv – удельная теплоемкость смеси, M1 – масса неона, M2 – масса водорода,
и , (1)
где сv – удельная теплоемкость смеси, M1 – масса неона, M2 – масса водорода,
и 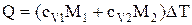 , (2) , (2)
|
| cp -? cv -? | где cv1 и сv2 – удельные теплоемкости неона и водорода соответственно. |
Приравняв правые части выражений (1) и (2) и разделив обе части полученного равенства на DТ, найдем
 ,
,
откуда 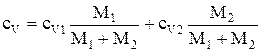 .
.
Отношения 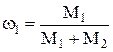 и
и  выражают массовые доли неона и водорода соответственно. С учетом этих обозначений последняя формула примет вид
выражают массовые доли неона и водорода соответственно. С учетом этих обозначений последняя формула примет вид
 .
.
Подставляя значения, получим сv=2,58×103  .
.
Таким же образом получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
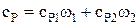 .
.
Подставляя значения, получим ср=3,73103 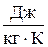 .
.
Ответ: сv=2,58×103  ; ср=3,73103
; ср=3,73103  .
.
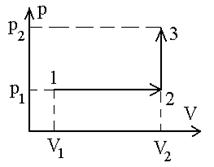
Задача 6 Кислород массой M=2 кг занимает объем V1=1 м3 и находится под давлением p1=2атм= 2,02×105 Па. Газ был нагрет сначала при постоянном давлении до объема V2=3 м3, а затем при постоянном объеме до давления p2=5атм=5,05×105 Па. Найти изменение внутренней энергии газа DU, совершенную им работу А и теплоту, переданную газу. Построить график процесса.
Дано:
| M = 2 кг V1 = 1 м3 p1 = 2,02× 105 Па p = const V2 = 3 м3 V = const p2 = 5,05 × 105 Па | Решение
Изменение внутренней энергии газа определяется по формуле
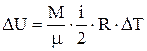 . (1)
Из уравнения Менделеева - Клапейрона . (1)
Из уравнения Менделеева - Клапейрона 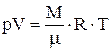 , выразим температуру: , выразим температуру:
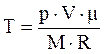 . (2)
V=const А2=0. . (2)
V=const А2=0.
|
| DU -? A -? Q -? |
Подставляя в формулу (2) значения давления и объема, получим значения температуры: Т1=389 К, Т2=1167 К. Из уравнения (1) DU=3,28×106 Дж.
Работа рассчитывается по формуле
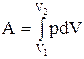 .
.
при p=const А1=0,404×106 Дж.
Полная работа, совершенная газом: А=А1+А2=0,404×106 Дж.
 На основании первого начала термодинамики
На основании первого начала термодинамики
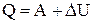
получаем теплоту, переданную газу: Q=3,68×106 Дж.
График процесса изображен на рисунке.
Ответ: DU=3,28×106 Дж; А=0,404×106 Дж; Q=3,68×106 Дж.
Задача 7 Идеальная тепловая машина работает по циклу Карно нагретым воздухом, взятом при начальном давлении 7×105 Па и температуре 127 0С. Начальный объем воздуха 2×10-3 м3. После первого изотермического расширения воздух занял объем 5 л, после адиабатического расширения объем стал равен 8 л. Найти координаты пересечения изотерм и адиабат.
Дано:
| p1 = 7× 105 Па T1 = 400К V1 = 2 × 10-3 м3 T = const V2 = 5 × 10-3 м3 Q = const V3 = 8 × 10-3 м3 |  Решение
Уравнение изотермы АВ имеет вид:
Решение
Уравнение изотермы АВ имеет вид:
|
| V1-? р1-? V2-? р2-? V3-? р3-? V4-? р4-? |
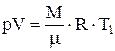 . (1)
. (1)
Для точки А: 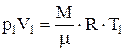 , откуда
, откуда  ,
,  = 0,427 моль, тогда уравнение (1) примет вид
= 0,427 моль, тогда уравнение (1) примет вид
pV = 0,427×8,31×400=1420 Дж.
Для точки В: 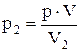 =284×103 Па.
=284×103 Па.
Поиск по сайту: