 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Зміст лекції. Міністерство освіти і науки України
Міністерство освіти і науки України
Волинський національний університет імені Лесі Українки
Хімічний факультет
Кафедра органічної та
біологічної хімії
ЛЕКЦІЯ З КУРСУ СТЕРЕОХІМІЯ
НА ТЕМУ: «Визначення конфігурації стереоізомерів»
Для студентів ІV курсу, спеціальність хімія
Підготувала
Cтудентка 5-го курсу
Романенко Алла Олександрівна
Луцьк – 2007
Лекція
Тема: Визначення конфігурації стереоізомерів.
Мета: Засвоїти теоретичні знання по темі «Визначення конфігурації стереоізомерів».
Завдання: Провести лекційне заняття по темі «Визначення конфігурації стереоізомерів».
Зміст лекції
Визначення просторової конфігурації – одне зосновних питань стереохімії. Коли ми отримали просторові ізомери, виникає питання: яка їх просторова будова, тобто конфігурація?
Маємо дві речовини (в загальному випадку їх може бути і більше), відносно яких відомо, що вони просторові ізомери; дві формули цих просторових ізомерів і потрібно буде взнати, якій речовині яка формула відповідає.
Підхід до вирішення питання просторової конфігурації відрізняється в залежності від того, про який тип просторових ізомерів іде мова – про π- чи σ-діастереомери, чи про енантіомери.
І. Визначення конфігурації π-діастереомерів
1) Визначення за дипольним моментом (діекломектрія )
Для багатьох π-діастереомерів характерні певні значення дипольних моментів:

а цис- б транс- (µ = 0)
В транс- формі при векторному складанні протилежно орієнтовані диполі однакових зв’язків взаємногасяться і сумарний дипольний момент рівний нулю (µ = 0); в цис- формі диполі зв’язків сумуються і утворюють сумарний дипольний момент молекули. Так, наприклад, у 1,2-дигалогенетиленів (а,б): для транс- ізомерів (б) дипольний момент рівний нулю; у випадку цис- ізомерів (а) дипольний момент залежить від природи атома галогену: 2,42 (F), 1,89 (Cl), 1,35 (Br) і 0,75Д (І). Для цис- ізомера дипольний момент завжди більший. Визначення дипольного моменту дає можливість встановити Z або Е конфігурації для π-діастереомерів.
2) Метод циклізації
Метод циклізації є одним з універсальних методів визначення Z і Е конфігурації для π-діастереомерів.
Ми знаємо, що існує деяка кислота – біла кристалічна речовина з tпл.=130°С, добре розчинна у воді з молекулярною формулою С4Н4О4 і структурною НООС–СН=СН–СООН (етилендикарбонова кислота); цю кислоту називають малеїновою. Але поряд з нею існує речовина з тією ж молекулярною масою і структурною формулою – кислота з tпл.=287°С, мало розчинна у воді – фумарола кислота. Тобто мова йде про π-діастереомери (геометричні цис-транс- ізомери), які можуть мати формули (1) і (2):

(1) (2)
Для того щоб встановити, якій кислоті відповідає та чи інша формула, проводять наступний експеримент. При нагріванні малеїнова кислота відщеплює воду і дає циклічний ангідрид (схема 1), фумарола кислота такого ангідриду не утворює. Оскільки для утворення циклічного ангідриду карбоксильні групи повинні бути наближені, то логічно, таке їх розташування в малеїновій кислоті (1). Фумаровій кислоті відповідно відповідає формула (2). Визначення конфігурації в даному випадку вирішується методом циклізації:
 (схема 1)
(схема 1)
малеїнова к-та малеїновий ангідрид
При визначенні конфігурації методом циклізації не повинен зачіпатись стеричний центр, тобто зв’язок sp2-гібридизованих атомів.
Метод циклізації був використаний і для визначення конфігурації комарової ікумаринової (о-гідроксикоричних) кислот. Кумаринова кислота існує лише у вигляді солей і ефірів, при виділенні вільної кислоти відбувається її самовільна циклізація з утворенням лактону – кумарину (4). Легкість циклізації вказує, що кумаринова кислота має цис- конфігурацію (3). Комарова кислота не циклізується і, відповідно, їй відповідає формула (5):

(3) кумаринова к-та (4) кумарин (5) комарова к-та
3) Хімічна кореляція
Хімічна кореляція – хімічне перетворення речовини з невідомою конфігурацією в речовину, конфігурація якої відома (або зворотній хімічний перехід від речовини з відомою конфігурацією до речовини з невідомою). Відповідно при цьому не повинен зачіпатись стеричний центр, тобто щоб реакція,що відбувається не зачіпала просторову будову речовини. Наприклад, із о-нітрокоричних кислот (6) і (7) серією хімічних перетворень (відновлення, діазотування, заміна діазо групи на групу ОН) через о-амінокоричні і о-діазокоричні кислоти отримують о-гідроксикоричні кислоти:
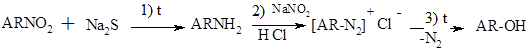
Встановивши, який із стереоізомерів о-нітрокоричної кислоти дає кумарову (5), а який кумаринові кислоту (3) [фактично не саму кислоту, а її лактон – кумарин (4)], можна тим самим доказати, яка із о-нітрокоричних кислот має транс-, а яка цис- конфігурацію (схема 2,3):

(6) транс- (5) схема 2

(7) цис- (4) схема 3
4)Метод ПМР-спектроскопії
 Метод дає можливість характеризувати структуру органічних речовин, зокрема визначати конфігурацію стереоізомерів. Внаслідок одержання сигналів від протонів сполуки, ПМР спектр містить пікі у вигляді синглетів, дублетів,триплетів і ін:
Метод дає можливість характеризувати структуру органічних речовин, зокрема визначати конфігурацію стереоізомерів. Внаслідок одержання сигналів від протонів сполуки, ПМР спектр містить пікі у вигляді синглетів, дублетів,триплетів і ін:
синглет дублет
Різниця між двома піками у Гц становить константу спін-спінової взаємодії (КССВ). Вона дає можливість сказати який ізомер отримали. КССВ для цис- форми лежить в межах 4÷12 Гц, а для транс- форми – 12÷18 Гц. Ізомери з меншими константами спін-спінової взаємодії мають цис-конфігурацію. Приклад 1,2-диброметилен:

цис- j = 4,7 Гц транс- j = 11,8 Гц
ІІ. Визначення конфігурації σ-діастереомерів та енантіомерів
1) Хімічна кореляція
При підході до проблеми конфігурації енантіомерів виникають деякі труднощі. Ми знаєм, що один антипод повертає вправо, інший вліво. Але насправді знак повороту – це чисто зовнішня ознака, не більша чим температура плавлення чи забарвлення речовини. Він не пов’язаний прямо з просторовою конфігурацією; більш того, відомі приклади, коли знак обертання міняється в залежності від умов – розчинника, температури, навіть концентрації.
Отже маємо дві речовини, одну з яких ми взнаєм по (+)-, іншу по (-)-обертанню; відомо, що їм відповідають дві дзеркальні формули. Треба визначити, яка формула якому антиподу відповідає.
На сьогоднішній день існує рентгенографічний метод визначення абсолютної конфігурації. Цим методом доказано, що (+)-винна кислота має конфігурацію:

Абсолютні конфігурації, визначені рентгенографічним методом, і лежать в основі стереохімічних кореляцій.
В якості простого прикладу розглянемо кореляцію конфігурацій гліцеринового альдегіду і винної кислоти. Взявши в якості вихідної речовини лівообертаючий ізомер гліцеринового альдегіду і вважаючи, що абсолютна конфігурація його поки не відома, застосуєм до нього ланцюг реакцій подовження вуглецевого скелету (приєднання НСN, гідроліз, окиснення первинної спиртової групи). Реакція не зачіпає центру хіральності:

гідроксинітрил 2,3,4-триоксибутанової к-ти 2,3,4-триоксибутанова к-та

2,3,4-триоксибутанова к-та мезо-винна к-та (α = 0) (+)-винна к-та (схема 4)
При цьому утворюються дві стереоізомерні винні кислоти, оскільки новий асиметричний центр иоже виникнути в двох конфігураціях (схема 4).
В мезовинній кислоті конфігурації асиметричних центрів протилежні і який з них був у вихідному гліцериновому альдегіді, встановити неможливо. Тому мезо-винна кислота не використовується для встановлення конфігурації. Другий продукт реакції – право обертаюча винна кислота з двома однаковими асиметричними центрами. Враховуючи, що один із них знаходиться у вихідному (-)-гліцериновому альдегіді і знаючи абсолютну конфігурацію (+)-винної кислоти, ясно, що (-)-гліцериновий альдегід має конфігурацію:

Далі, з вихідним (-)-гліцериновим альдегідом провели ряд хімічних перетворень і отримали винну кислоту. Після цього виконали поляриметричне вимірювання, щоб вияснити, яка із антипод них винних кислот утворилася. Взнавши, що отримали (+)-винну кислоту, абсолютна конфігурація якої встановлена по рентгеноструктурним даним, робим висновок, що така ж була і конфігурація вихідного (-)-гліцеринового альдегіду.
Тепер коли відома конфігурація (-)-гліцеринового альдегіду методом перетворень можна отримати речовину про будову якої можна говорити, наприклад (+)-гліцеринову кислоту:

2) Метод оптичного порівняння
В основі методу оптичного порівняння лежать два правила Бугайова:
1) величина молярного обертання в гомологічному ряду є постійна:

де [М] – величина молярного обертання;
2) хімічні перетворення, що здійснюються не біля сусідніх атомів з центром хіральності дуже мало впливає на величину молярного обертання. Це правило часто називають «правилом близькості». Наприклад, багато сполук загальної формули (8) мають праве обертання незалежно від природи замісника Х (Н, Наl, NH2, COOH, CONH2).

Метод оптичного порівняння, розвинений Фрейденбергом, базується на використанні наступних закономірностей, безпосередньо витікаючи із правил Чугайова:
1) аналогічні сполуки однакової конфігурації мають подібні зміни оптичного обертання, якщо в них проводяться однакові хімічні зміни (правило оптичного зміщення);
2) оптичне обертання подібно побудованих сполук однакової конфігурації мають однакові зміни під дією розчинника, температури і ін. факторів.
Використовуючи метод оптичного порівняння, Фрейденберг встановив конфігуративний зв’язок гідрокси- і амінокислот. Порівняння було виконано, наприклад, для пари L-(-)-яблучна кислота і аспарагінова кислота. Порівнювались діетилові ефіри різних O-(чи N)-похідних цих кислот (таб. 1)

L яблучна к-та аспаргінова к-та
Таб. 1
| Х | Діетиловий естер яблучної к-ти (-) | Діетиловий естер аспарагінової к-ти | |
| (+) | (-) | ||
| PhCO | -18 | +12 | -12 |
| HCO | -58 | -13 | +13 |
| CH3CO | -68 | -18 | +18 |
| C2H5-SO2 | -101 | -31 | +31 |
Із даних, наведених в таблиці 1., видно що в ряді похідних L-(-)-яблучної кислоти поступово збільшується ліве обертання, а в ряді похідних (+)-аспаргінової кислоти той же «зсув в ліво» проявляється у зменшенні правого обертання і потім в наростанні лівого обертання. Таким чином, (+)-аспаргінова кислота має подібну конфігурацію з L-(-)-яблучною кислотою.

L-(-)-яблучноа к-та L-(+)-аспаргінова к-та D-(-)-аспаргінова к-та
Для встановлення конфігураціонної схожості, важливо не співпадання обертання по знаку, не збільшення чи зменшення іх, а сам напрям зсуву (вправо чи вліво) в якомусь ряді похідних, що однаковий для порівнюваних сполук.







Висновок: Розглянули тему «визначення конфігурації стереоізомерів», а саме π-, σ-діастереомерів та енантіомерів. Методами визначення конфігурації для π-діастереомерів є визначення за дипольним моментом (діеклометрія), метод циклізації, хімічна кореляція, метод ПМР спектроскопії,а для σ-діастереомерів і енантіомерів – хімічна кореляція та метод оптичного порівняння.
Поиск по сайту: