 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Химическая связь
Метод валентных связей (метод ВС).
(Задачи №№ 41¸8)
Метод ВС используется для объяснения природы ковалентной связи. Согласно данному методу, ковалентная связь – это связь за счёт общей пары электронов с антипараллельными спинами, которая образуется при перекрывании 2-х АО соединяющихся атомов. Общая электронная пара может образовываться по обменному и донорно-акцепторному механизму[9].
При обменном механизме ковалентная связь образуется путём обобществления неспаренных электронов обоих соединяющих атомов. Очевидно в связи с этим, что число связей, образуемых атомом по обменному механизму – его валентность (ковалентность) – равно числу неспаренных электронов.
Пример 4.1.1.1. Образование ковалентной связи между атомами водорода.
Атом водорода – простейший атом с единственным валентным s-электроном. Естественно, что каждый атом водорода способен участвовать в образовании только одной общей пары электронов. Это выражают, говоря, что водород – одновалентный элемент.
Записываем схему образования ковалентной связи между атомами водорода: H ˙ +H ˙ →H: H [10]. Электронная схема молекулы водорода ясно указывает на наличие только одной ковалентной связи (одной общей пары электронов) между атомами.
Пример 4.1.2. Образование ковалентных связей между атомами N и H.
Атомы азота и водорода, взаимодействуя, образуют молекулы аммиака: N + 3H = NH3.
|
|

Из графической схемы валентных подуровней видно, что имея 3 неспаренных электрона, атома азота способен образовать 3 ковалентные связи по обменному механизму. Изображаем графически схему перекрывания 3-х р-АО атома азота с s-АО 3-х атомов водорода, записываем электронную и валентную схему образующейся молекулы NH3: электронная схема молекулы: Валентная схема молекулы:
|
|

Электронная и валентная схемы молекулы показывают, что валентность азота равна 3, а валентность каждого атома водорода равна 1.
Число ковалентных связей, образуемых атомом по обменному механизму, может увеличиваться в результате его возбуждения. [11] При возбуждении атома происходит разъединение спаренных электронов и их перехода в свободные АО того же уровня.
Пример 4.1.3. валентность атомов фтора и хлора в невозбуждённом и возбуждённых состояниях.
|
 Записываем электронные формулы атомов фтора и хлора в стационарном состоянии, определяем валентные подуровни (в электронных формулах подчёркнуты) и представляем графически их электронные значения.
Записываем электронные формулы атомов фтора и хлора в стационарном состоянии, определяем валентные подуровни (в электронных формулах подчёркнуты) и представляем графически их электронные значения.
9F[1s2 2s22p5]
|
| ||||
 |
17Cl[1s22s22p6 3s23p5]
Являясь электронными аналогами, атомы F и Cl отличаются тем, что в атоме F внешний слой является насыщенным, тогда как во внешнем слое атома Cl имеется свободный 3d- подуровень. Поэтому атом F не может подвергаться возбуждению и, следовательно, его валентность повышаться так же не может. В атоме же Cl возбуждение возможно т.к. возможен переход валентных электронов в АО свободного 3d- подуровня. При возбуждении атома Cl происходит разъединение спаренных валентных электронов, следствием чего является повышение валентности вплоть до значения, равного номеру группы. Изобразим графически возбуждение атома Cl.
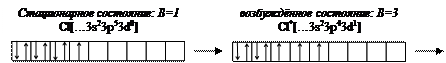
[12]
 |
Таким образом, по обменному механизму атом может образовывать ограниченное число ковалентных связей соответственно числу неспаренных электронов. В этом заключается одно из двух важнейших свойств ковалентной связи – её насыщаемость. Вторым главным свойством ковалентной связи является её направленность, обусловленная тем, что перекрывание АО происходит в определённом направлении по отношению к взаимодействующим атомам.
В зависимости от направления перекрывания АО различают σ-, π- и δ-связи.[13] σ-связь образуется при перекрывании двух АО в направлении оси связи, а π-связь – при перекрывании АО в направлении перпендикуляра к оси связи. [14] σ-связь может образовываться при взаимодействии АО любой формы; при этом, область перекрывания АО находится между ядрами атомов на оси связи. π-связь образуется при взаимодействии только p- или d-АО; она характеризуется двумя областями перекрывания, лежащими по обе стороны от оси связи.
Пример 4.1.4. Образование ковалентных связей между невозбуждёнными атомами P и As.
Записываем электронные формулы атомов, определяем валентные подуровни (в электронных формулах подчёркнуты), изображаем графически их электронное строение и даём графическое объяснение образования связей между атомами: 15P[1s22s22p6 3s23p3 ]; 33As[1s22s22p63s23p63d10 4s24p3 ].
 | |||
| |||
|
Из электронной и валентной схем видно, что атомы P и As связаны тройной связью. [15] Поскольку на оси связи между ядрами соединяющихся атомов возможно существование только одной области перекрывания, в тройной связи молекулы AsP имеется только одна σ-связь, образующаяся, например, в направлении координатной оси «х»; остальные 2 связи являются π-связями, образующимися в направлении координатных осей «у» и «z».
Из рассмотренного примера вытекает общий вывод: в любой кратной связи одна связь является σ-связью, все остальные – π-связями.
Поиск по сайту: