 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Метод молекулярных орбиталей (метод МО)
(Задачи №№ 81¸100)
Метод МО является более общим и универсальным, чем метод ВС, т.к. позволяет объяснить факты, необъяснимые с позиций метода ВС. В частности, метод МО успешно объясняет образование и основные свойства не только молекул, но и молекулярных ионов.
Суть метода МО заключается в том, что при соединении атомов или ионов исходные АО превращаются в новые – в молекулярные орбитали, охватывающие все ядра атомов образующейся молекулы или молекулярного иона. При этом количество образующихся МО равно суммарному числу взаимодействующих АО связывающихся атомов, причём, половина из образующихся МО являются связывающими, другая половина – разрыхляющими. Связывающей МО соответствует более низкий, а разрыхляющей – более высокий энергетический уровень по сравнению с исходными АО.
Пример 4.2.1. Образование связывающей и разрыхляющей МО при взаимодействии 2-х АО равной энергии.
Составляем энергетическую схему исходных АО и образующихся МО.
 Разрыхляющая МО
Разрыхляющая МО
Связывающая МО
Атомные орбитали могут взаимодействовать, образуя МО по s- и p-типу. При обозначении МО указывается её тип, подстрочным индексом обозначаются исходные АО, образующие МО, или направление взаимодействующих АО, если МО образуется из p-АО, и далее в строке указываются взаимодействующие АО конкретного подуровня; для обозначения разрыхляющих МО используется надстрочный символ «звёздочка». Например, обозначение ss2s означает, что речь идёт о связывающей МО, образованной по s-типу в результате взаимодействия s-АО 2s-подуровня; обозначение py*2py отвечает разрыхляющей МО, образованной по p-типу взаимодействием p-АО 2p-подуровня, ориентированных в направлении координатной оси «у».
В молекуле или в молекулярном ионе молекулярные орбитали заполняются электронами так же, как и атомные орбитали в атоме, т.е. в соответствии с принципом Паули, принципом наименьшей энергии и правилом Хунда. По уровню энергии молекулярные орбитали, образующихся при взаимодействии АО первых двух электронных слоёв (К- и L-слоёв), располагаются в следующем порядке (в этом же порядке происходит заполнение МО электронами): ss1s<ss*1s<ss2s<ss*2s<ss2px<py2py=pz2pz<py*2py=pz*2pz<ss*2px.
Электроны связывающих и разрыхляющих МО оказывают противоположное влияние на устойчивость молекулы или молекулярного иона: электроны разрыхляющих МО нивелируют связывающее действие электронов, занимающих связывающие МО. В связи с этим в методе МО порядок (кратность) связи определяется по разности между числом связывающих (ЧСЭ) и разрыхляющих электронов (ЧРЭ) по формуле: Порядок связи=(ЧСЭ – ЧРЭ)/2.
Пример 4.2.1. Образование молекулы He2 и молекулярного иона He2 +.
Молекула He2 образуется при взаимодействии атомных орбиталей K-электронного слоя двух атомов He[1s2], в результате чего образуются одна связывающая ss1s-МО и одна разрыхляющая ss*1s-МО, которые и заполняются электронами исходных атомов. Образование связи в молекуле He2 записывается следующим образом:He[1s2]+He[1s2]®He2[(ss1s)2(ss1s)2]. [16]
Определяем порядок связи: порядок связи=(2-2)/2=0 – молекула He2.не существует.
Молекулярный ион He2+ содержит на один электрон меньше, чем молекула He2. Соответственно этому его электронная формула записывается: He2+[(ss1s)2(ss*1s)1].
Порядок связи в ионе He2+: (2-1)/2=1/2 – порядок связи отличен от нуля, следовательно, молекулярный ион He2+, в отличие от молекулы He2,, может существовать.
Пример 4.2.2. Образование молекулы Li2 и молекулярных ионов Li2 + и Li2 2-.
Записываем схему образования связи в молекуле Li2: Li[1s22s1]+Li[1s22s1]®Li2[(ss1s)2(ss*1s)2(ss2s)2].
Порядок связи=(4-2)/2=1 – молекула Li2 существует, кратность связи равна 1.
Из электронной формулы молекулы видно, что взаимодействие 1s-атомных орбиталей насыщенного K-электронного слоя не приводит к образованию связи: число электронов в ss1s- и в ss*1s-МО одинаково. Связь образуется исключительно за счёт взаимодействия АО внешнего электронного слоя. Поэтому в электронных формулах молекул и молекулярных ионов такие МО принято обозначать индексами соответствующих электронных слоёв. В связи с этим в упрощённом варианте электронная формула молекулы Li2 записывается: Li2[KK(ss2s)2].
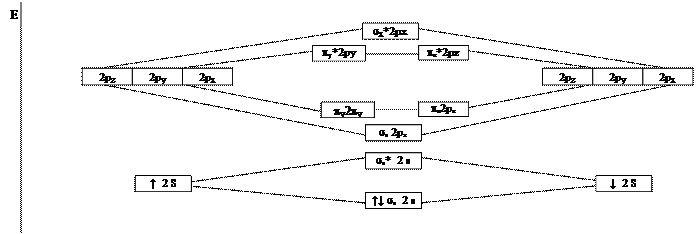 Изобразим графически энергетическую схему исходных АО и образующихся МО в системе из двух атомов Li.
Изобразим графически энергетическую схему исходных АО и образующихся МО в системе из двух атомов Li.
Молекулярный ион Li2+ содержит на один электрон меньше, чем молекула Li2. Его электронная формула записывается: Li2+[KK((ss2s)1]. Порядок связи=(1-0)/2=1/2. Следовательно, молекулярный ион Li2+ может существовать.
Молекулярный ион Li22- по сравнению с молекулой Li2 имеет на 2 электрона больше, которые заполняют ss*2s-МО. Определяем порядок связи: (2-2)/2=0 – молекулярный ион Li22- существовать не может.
Сопоставляя порядок связи в рассматриваемых частицах, приходим к выводу, что наиболее прочная связь образуется в молекуле Li2.
[1] Для атомной орбитали и электронов в ней приняты следующие условные графические обозначения:
- вакантная АО, - АО с неспаренным электроном; - АО со спаренными электронами.
[2] Цифрой обозначается энергетический уровень, которому принадлежит подуровень, затем следует буквенное обозначение подуровня. Например, запись 3d означает, что речь идёт о d-подуровне третьего энергетического уровня.
[3] Количество электронов в подуровне указывается надстрочным индексом, следующим за буквенным обозначением подуровня. Например, запись 3p4 означает, что в p-подуровне 3-го энергетического уровня находятся 4 электрона.
[4] Электронная формула атома, отвечающая принципу наименьшей энергии (правилу Клечковского), отражает его электронную конфигурацию в наиболее устойчивом – стационарном состоянии; все остальные состояния атома являются возбуждёнными.
[5] Все известные химические элементы образуют 4 электронных семейства: s-, p-, d-, f-.
[6] Для отрыва каждого последующего электрона требуются дополнительные, всё более высокие энергетические затраты. Поэтому различают первую энергию ионизации – I1, вторую – I2, третью – I3 и т.д. Причём, I1<I2<I3<…<I i.
[7] По вполне объяснимым причинам, которые здесь не обсуждаются, в периоде происходит нарушение монотонного увеличения энергии ионизации при переходе от 2-го к 3-му и от 5-го к 6-му элементу периода.
[8] Имеются ввиду элементы VIIА-группы, т.к. для элементов VIIIA-группы, в связи с особо высокой устойчивостью электронной конфигурации ns1np6, не характерны ни процессы присоединения, ни процессы отдачи электронов.
[9] Образование ковалентных связей по донорно-акцепторному механизму в контрольной работе не рассматривается.
[10] При рассмотрении процессов образования ковалентных связей валентные электроны взаимодействующих атомов принято обозначать точками, причём, неспаренные электроны обозначают одинарными точками, спаренные электроны – двойными. Общие электронные пары (электроны связей) указывают двойными точками, проставляемыми между символами связанных атомов.
Форма записи молекулы с обозначенными электронами связи называется её электронной схемой. Для обозначения связей помимо электронных схем пользуются также валентными схемами, в которых химическая связь указывается валентной чертой. Например, валентная схема молекулы водорода: Н-Н.
[11] Возбуждение атома происходит при поглощении им энергии, вследствие чего электрон переходит на подуровень с большей энергией.
[12] Возбуждённое состояние атома указывается символом элемента со «звёздочкой»
[13] δ-связи в контрольной работе не рассматриваются.
[14] Ось связи – воображаемая линия, соединяющая ядра взаимодействующих атомов.
[15] Двойные и тройные связи называются кратными связями.
[16] Число электронов в МО, как и в АО, указывается в виде показателя степени. Запись распределения электронов по молекулярным орбиталям называется электронной формулой.
Поиск по сайту: